Домашние и профессиональные методы определения жесткости воды
Содержание:
- Альтернативные способы проверки
- Почему нужно уметь измерять жёсткость воды
- Немного о жесткости воды
- Что такое жёсткая вода и что на неё влияет?
- Как определить жесткость воды с помощью хозяйственного мыла?
- Жесткость воды. Соли жесткости
- Вред, наносимый такой водой
- Жесткая и мягкая вода
- Методы устранения жесткости
- Что влияет на норму?
- Жесткость и качество воды
- Как определить жесткость воды с помощью домашнего прибора?
Альтернативные способы проверки
К сожалению, не всегда возможно доставить воду в лабораторию за нужное время: удалённость, пробки, собственная занятость.

Простые тесты, чтобы дома определить жёсткость воды:
- Заваривание листового чая. Если настоявшийся напиток становится мутным, вязким и покрывается плёнкой, это говорит о высоком содержании кальция и магния. О низком качестве сигнализирует и металлический привкус.
- Намыливание рук. Если пена образуется моментально, то вода достаточно мягкая, если нет — налицо высокое содержание солей. Проверять лучше хозяйственным мылом. Пена появится тогда, когда мыло свяжет избыток солей кальция и магния.
- Если посуда плохо отмывается, а вещи не простирываются — это сигнал о том, что пора смягчать воду.
- Прозрачность воды — явный признак её качества. Если через стакан, наполненный водой, легко читается текст на газете, то можно говорить о нормальной жёсткости.
- Капните воду на прозрачное стекло и дождитесь испарения капли. Если остался след — вода жёсткая.
- Ещё один тест: растворите кристаллы марганцовки и посмотрите, обрела ли она желтоватый оттенок. При нормальной жёсткости этого не случится.

Тест на вкус: налейте воду в чистую ёмкость и прокипятите 5 минут. Остудите до 25 градусов. Попробуйте воду: если есть горький привкус — в ней избыток солей магния, терпкий вкус — это признак повышенного содержания железа. Гипсовая составляющая в воде определяется как сладковатый привкус.
Простой тест на образование пены:
- Подготовьте три образца: две бутылки магазинной воды с разной жёсткостью и одну из-под крана.
- Насыпьте в ёмкости одинаковое количество мыльной стружки и взболтайте.
- Измерьте высоту пены линейкой и сопоставьте образцы. Если водопроводная вода образовала пену ниже, чем бутилированная, то она ниже по качеству.
Тем, кому нужен более точный результат, но у кого нет намерения ехать в лабораторию, стоит обратить внимание на прибор для измерения жёсткости воды TDS-3. Устройство требует навыков в обращении, но по инструкции вполне доступно разобраться в принципе его работы

Почему нужно уметь измерять жёсткость воды
Слишком жёсткая или слишком мягкая вода может нанести непоправимый вред как бытовым приборам, так и здоровью людей. Мягкая вода вымывает из организма кальций, из-за чего разрушаются кости и зубы. В такой воде активно коррозируют металлические поверхности. Чтобы этого избежать, используют ингибитор коррозии.
Вред жёсткой воды:
- создает слишком большую солевую нагрузку для мочеполовой системы. Возможно появление мочекаменной болезни, ухудшение состояния волос и кожи; неблагоприятно действует на теплотехнические и сантехнические системы, приносит немалый вред бытовой технике;
- приходится тратить больше тепла на нагрев воды: слой накипи (осадок из солей жесткости), появившийся на ТЭНах, обладает низкой теплопроводностью. Из-за недостаточного отвода тепла нагревательные элементы часто сгорают;
- увеличивается расход моющих средств из-за того, что поверхностно-активные вещества (ПАВ), входящие в состав, дают с солями кальция и магния нерастворимые соединения и не образуют достаточного для удаления загрязнений количества пены;
- стенки трубопроводов быстро зарастают известковыми отложениями, поэтому в водопроводной системе снижается напор, трубы приходится менять.
Прежде чем покупать дорогие устройства и реагенты, выясните, какие соли и в каком количестве присутствуют в водопроводной воде. Показатель общей жёсткости меняется в зависимости от количества осадков, таяния снега и других явлений, влияющих на концентрацию солей. Чтобы правильно выбрать умягчители, сначала сделайте анализ на определение жёсткости воды.
Для бытовых целей: умывания, стирки и уборки, – достаточно выяснить показатель жесткости воды один раз и в случае необходимости использовать подходящие средства. Для приготовления пищи, если водопроводная слишком вода жёсткая, целесообразно использовать бутилированную воду хорошего качества, которую периодически проверять портативным и несложным в обращении прибором для определения общей и карбонатной жёсткости.
Немного о жесткости воды
Поставка воды, горячей и холодной, потребителю требует от предприятия, которое несет ответственность за этот процесс, соблюдения определенных норм. Их регламентируют ГОСТы, Санитарные правила и нормы (СанПиН) и другие нормативные документы, согласно которым определяется соответствие требованиям.

Отметим некоторые особенности:
- Питьевая вода средней степени жесткости считается относительно нормальным явлением в водопроводных системах, она же – наиболее частый вариант в родниковой и добываемой из артезианских скважин.
- Мягкая – это дождевая (хотя в современной неблагоприятной экологии она может с огромной степенью вероятности содержать вредоносные примеси). Под это определение подпадает жидкость, подвергавшаяся длительному кипячению, не очень желательная для применения в пищевых нуждах, и дистиллированная, полностью от них избавленная.
- К жесткой относится любая вода (из моря, океана или вытекающая из минеральных напластований) с большим содержанием в ней примесей. Они могут превышать треть общего объема исследуемой жидкости, и только 2/3 приходятся на привычные атомы водорода и кислорода.
Применяя жесткую жидкость в работе с бытовой техникой, можно быстро прийти к необходимости ремонта. Обычное мыло при ручной стирке или при мытье в ней растворяется плохо.
О норме жесткости
Проблема соответствия необходимому показателю жесткости воды в водопроводном кране состоит не только в источнике, из которого она добывается. Общая жесткость воды бывает постоянной и временной.

И если вторую, карбонатную кальциевую и магниевую, можно нейтрализовать кипячением, то перманентно присутствующая может повлиять на состояние здоровья потребителя, исправность стиральной машины или чайника. Она практически ничем не устранима.
Природная вода может менять свои показатели в результате сезонной миграции потоков от дождя и таяния снега. Зимой, когда таких явлений в природе не наблюдается, уровень показателей обычно становится более жестким.

Что такое жёсткая вода и что на неё влияет?
Степень жёсткости воды определяется как совокупность свойств, зависящих от содержания магния, кальция и других растворённых солей. Общий показатель складывается из постоянной и временной составляющей:
- Временная (карбонатная) устраняется кипячением благодаря способности ряда солей выпадать в осадок с образованием накипи. Характеризуется наличием бикарбонатов магния и кальция – при рН>8.3.
- Постоянная (некарбонатная) сохраняется при кипячении. Характеризуется наличием солей магния и кальция хлоридных, сульфатных и нитратных анионов.
На величину жёсткости влияют следующие факторы:
- интенсивность растворения гидропотоками горных пород (известняков, доломитов),
- использование подземных или поверхностных вод (поверхностные при прочих равных более «мягкие»),
- сезонные колебания для поверхностных ресурсов (показатель максимальной «мягкости» отмечается в периоды паводков и половодий с активным поступлением дождевых и талых «пополнений» в источники водоснабжения, а минимальная «мягкость» приходится на зимний период).
Как определить жесткость воды с помощью хозяйственного мыла?
Есть еще один увлекательный опыт, который можно провести дома, чтобы определить жесткость воды. Он дает погрешность до 1-2°Ж.
- Возьмите 72% хозяйственное мыло. Допустимо и в 60%. Отмеряем ровно 1 г – это примерно 1/3 ч. л.
- Наливаем в стакан с горлышком шириной в 6 см немного дистиллированной воды (буквально 10-12 мл) – это примерно на 2 см от низа. Опыт не очень точный, поэтому погрешность допускается, и небольшое расхождение в миллиметрах не страшно. Но для своего же удобства приклейте от начала внутреннего дна стакана бумажную линейку снаружи. Совет: Проверьте все же воду для данного эксперимента. Не всегда покупная жидкость соответствует требованиям. Хоть незначительные, но возможны отклонения от нормы. Но в таком случае – опыт даст большую погрешность.
Подогреваем воду, чтобы мыло быстрее растворилось, и всыпаем измельченный кусочек мыла. Аккуратно, с минимальным образованием пены перемешиваем до полного растворения.
Теперь доливаем еще дистиллированной воды до отметки 7,2 см от внутреннего дна! Если у вас 60% мыло, то до черты в 6 см. Снова перемешиваем и при необходимости снимаем пену.
Берем литровую банку, набираем 0,5 л тестируемой воды. Теперь аккуратно вливаем мыльную воду и активно помешиваем ложкой. Стоит добавлять мыльный раствор до тех пор, пока не образуется устойчивая пена. Таковой ее можно считать, если после прекращения перемешивания она сразу же не падает.
Далее надо вычесть использованные сантиметры мыльной воды и перевести их нужные единицы измерения по таблице.
| Градусы dH | Характер воды | Жесткость в мг-экв/л |
| 0–4° | Очень мягкая | до 1,5 мг-экв/л |
| 5–8° | Мягкая | 1,5–4 мг-экв/л |
| 9–12° | Средней жесткости | 4–8 мг-экв/л |
| 13–22° | Жесткая | 8–12 мг-экв/л |
| 23–34° | Очень жесткая | выше 12 мг-экв/л |
Сравнение результатов
Жесткость воды. Соли жесткости
Жесткость воды — это совокупность химических и физических свойств воды, связанных с содержанием в ней растворенных солей щелочноземельных металлов, главным образом, кальция и магния (так называемых «солей жесткости»).
Соли жесткости имеют разные свойства. Так, при нагреве воды, некоторые из них выпадают в осадок в виде накипи, а некоторые — не выпадают. По этому признаку их и начали разделять.
Соли, выпадающие в осадок, стали называть солями временной (или устранимой) жесткости, а соли, которые не выпадают в осадок при нагреве воды, солями постоянной жесткости.
Сульфаты, хлориды и нитраты магния и кальция, растворенные в воде, образуют постоянную (или некарбонатную) жесткость. Они выпадают в осадок исключительно при полном испарении воды.
Временная жесткость характеризуется присутствием в воде наряду с катионами Ca2+, Mg2+ и Fe2+ гидрокарбонатных, или бикарбонатных анионов (HCO3-).
При кипячении воды гидрокарбонаты разлагаются, образуя очень плохо растворимый карбонат кальция, углекислый газ и воду:
Общая жесткость складывается из постоянной и временной.
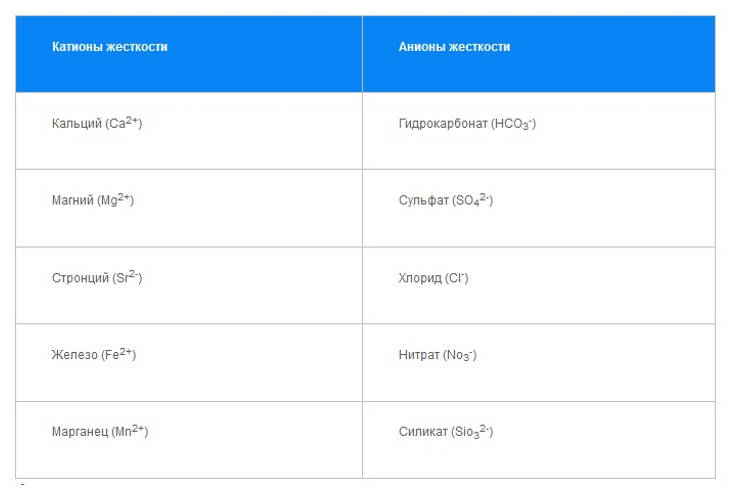
В данной таблице приведены основные катионы металлов, вызывающие жесткость, и главные анионы, с которыми они ассоциируются.
| Катионы | Анионы |
| Кальций (Ca2+) | Гидрокарбонат (HCO3-) |
| Магний (Mg2+) | Сульфат (SO42-) |
| Стронций (Sr2+) | Хлорид (Cl-) |
| Железо (Fe2+) | Нитрат (NO3-) |
| Марганец (Mn2+) | Силикат (SiO32-) |
На практике стронций, железо и марганец оказывают на жесткость столь небольшое влияние, что ими, как правило, пренебрегают. Алюминий (Al3+) и трехвалентное железо (Fe3+) также влияют на жесткость, но при уровнях рН, встречающихся в природных водах, их растворимость и, соответственно, «вклад» в жесткость ничтожно малы. Аналогично, не учитывается и незначительное влияние бария (Ва2+).
Жёсткость воды — происхождение
Ионы кальция (Ca2+) и магния (Mg2+), а также других щелочноземельных металлов, обуславливающих жесткость, присутствуют во всех минерализованных водах. Их источником являются природные залежи известняков, гипса и доломитов.
Ионы кальция и магния поступают в воду в результате взаимодействия растворенного диоксида углерода с минералами и при других процессах растворения и химического выветривания горных пород.
Источником этих ионов могут служить также микробиологические процессы, протекающие в почвах на площади водосбора, в донных отложениях, а также сточные воды различных предприятий.
Обычно в маломинерализованных водах преобладает (до 70%-80%) жесткость, обусловленная ионами кальция (хотя в отдельных редких случаях магниевая жесткость может достигать 50-60%).
С увеличением степени минерализации воды содержание ионов кальция (Са2+) быстро падает и редко превышает 1 г/л.
В целом, жесткость поверхностных вод, как правило, меньше жесткости вод подземных. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость (десятки и сотни мг-экв/дм3).
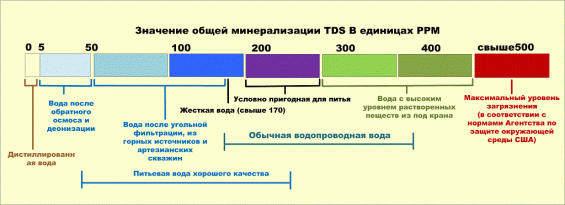
Жесткость воды — единицы измерения
С 1 января 2014 года в России введен межгосударственный стандарт ГОСТ 31865-2012 «Вода. Единица жесткости». По новому ГОСТу жесткость выражается в градусах жесткости (°Ж).
1 °Ж соответствует концентрации щелочноземельного элемента, численно равной 1/2 его миллимоля на литр (1 °Ж = 1 мг-экв/л). В разных странах использовались (иногда используются до сих пор) различные внесистемные единицы — градусы жёсткости.
За рубежом приняты другие единицы измерения жесткости воды, соотношение этих единиц представлено ниже:
1°Ж = 20,04 мг Ca2+ или 12,15 Mg2+ в 1 дм3 воды;
1°DH = 10 мг CaO в 1 дм3 воды;
1°Clark = 10 мг CaCO3 в 0,7 дм3 воды;
1°F = 10 мг CaCO3 в 1 дм3 воды;
1 ppm = 1 мг CaCO3 в 1 дм3 воды.
Численные значения жесткости измеренные в мг-экв/л, моль/м3, и °Ж, несмотря на различия в обозначении, равны между собой.
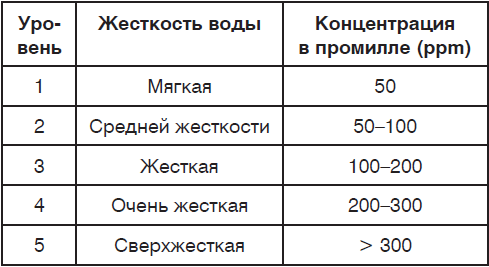
По значению общей жесткости природные воды делят на группы:
- очень мягкая вода (0–1,5 мг-экв/л)
- мягкая вода (1,5–4 мг-экв/л)
- вода средней жесткости (4–8 мг-экв/л)
- жесткая вода (8–12 мг-экв/л)
- очень жесткая вода (более 12 мг-экв/л).
Нормативные требования и рекомендации
Рекомендации всемирной организации здравоохранения (ВОЗ) для питьевой воды:
кальций – 20-80 мг/л; магний – 10-30 мг/л. Для жесткости какой-либо рекомендуемой величины не предлагается.
Вред, наносимый такой водой
Специалисты называют несколько десятков примеров того, чем вредна жесткая вода. Причем отражается это и на здоровье человека с его домашними питомцами, и на состоянии техники. Чем жестче жидкость и длительнее ее воздействие, тем явнее и сильнее негативное влияние ее на все, с чем она контактирует.
Вред для человека

На людей и их домашних любимцев такая вода по результатам многочисленных исследований оказывает следующее негативное влияние:
- Способствует мочекаменной болезни. Это связано с тем, что в организме накапливается много вредных примесей, содержащихся в напитках, происходит застой солей, которые не успевают выводиться с мочой, а это приводит к росту камней.
- Провоцирует ускорение процессов старения. Связано это с тем, что она очень сильно сушит кожу и лишает ее необходимой влаги. К тому же, если вы используете при умывании мыло, его частички не могут полностью раствориться, а значит, не вымываются до конца с кожи. Еще одна проблема, которую приносит такая жидкость эпидермису – различные высыпания, раздражения, прыщи, гнойники.
- Повреждает тонкий защитный слой – естественную жировую плёнку на коже головы и волосах. Это приводит к их ломкости, истончению и выпадению. К тому же, локоны теряют упругость и здоровый блеск, приобретают блеклость и тусклость. Может также возникнуть зуд. Страдают от такой жидкости и ногти.
- Переваривание пищи замедляется, а всасываемость полезных веществ из нее – снижается. Жесткая вода может вызвать различные заболевания ЖКТ.
Вред для приборов и предметов быта

Вредна такая вода и для бытовых приборов:
- Мыло и другие чистящие средства становятся менее эффективными и наносятся в большем количестве. Они хуже пенятся и отмывают грязь, а также плохо вымываются с различных поверхностей.
- Жесткая вода приводит к тому, что в результате химической реакции после чистки мебели, окон и различных бытовых приборов, на их поверхности остаются разводы. Порой этот налет становится твердым и очень сложно смывается при повторной обработке. Остаются следы и на посуде, и на сантехнике. На приведение вещей в порядок требуется больше времени и сил, да и приходят в негодность они значительно раньше обычного.
- Портятся не только предметы быта, но и наша одежда. Вещи при частой стирке теряют свой яркий цвет, получают разводы и пятна, а рисунки на них перестают быть красочными. Причем, одежда, полотенца и другие текстильные принадлежности теряют не только привлекательный внешний вид, но и становятся грубыми и неэластичными.
- Страдает от жесткости все, что нагревается. Это кастрюли, стиральные машины, обычные и электрочайники, мультиварки, кофеварки, бойлеры, посудомойки, утюги и парогенераторы. При нагревании и кипячении воды с повышенной жесткостью соли, содержащиеся в ней, превращаются в кристаллы и выпадают в осадок, значительно сокращая срок эксплуатации техники.
- Из-за отложения солей выходят из строя трубы, батареи, отопительные установки. Значительно падает теплоотдача радиаторов. Пропадает напор в кране.
Жесткая и мягкая вода
Вода с большим содержанием солей называется жёсткой, с малым содержанием — мягкой. Термин «жёсткая» по отношению к воде исторически сложился из-за свойств тканей после их стирки с использованием мыла на основе жирных кислот — ткань, постиранная в жёсткой воде, более жёсткая на ощупь. Этот феномен объясняется, с одной стороны, сорбцией тканью кальциевых и магниевых солей жирных кислот, образующихся в процессе стирки на макроуровне. С другой стороны, волокна ткани обладают ионообменными свойствами, и, как следствие, свойством сорбировать многовалентные катионы — на молекулярном уровне.
Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2, и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Жёсткая вода при умывании сушит кожу, в ней плохо образуется пена при использовании мыла. Использование жёсткой воды вызывает появление осадка (накипи) на стенках котлов, в трубах и т. п. В то же время, использование слишком мягкой воды может приводить к коррозии труб, так как, в этом случае отсутствует кислотно-щелочная буферность, которую обеспечивает гидрокарбонатная (временная) жёсткость. Потребление жёсткой или мягкой воды обычно не является опасным для здоровья, однако есть данные о том, что высокая жёсткость способствует образованию мочевых камней, а низкая — незначительно увеличивает риск сердечно-сосудистых заболеваний.[источник не указан 561 день] Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Жёсткость природных вод может варьироваться в довольно широких пределах и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда.
Методы устранения жесткости
Их несколько, все – эффективные. Выбирать следует, ориентируясь на конкретные показатели и степень эксплуатации – постоянно или сезонно.
Термоумягчение
Иными словами, это обычное кипячение. Следует немного приоткрыть крышку и ждать полного осадка примесей. Но если концентрация превышает 4 мл на литр, то способ не эффективен, поскольку испарение влаги произойдет быстрее, чем полное осаждение частиц.
Реагентное умягчение
В качестве реагентов чаще всего выступает обычная пищевая сода и известь. Они поочередно вводятся в раствор, отдельные химические элементы вступают с ними в реакцию с высвобождением Н2О и выпадают в осадок.
Катионирование
Это обессоливание с использованием катионов натрия или водорода. В первом случае это добавление обычной поваренной соли – что недорого, а также просто в утилизации продуктов регенерации.
Обратный осмос
В качестве фильтра выступает мембрана из ацетилцеллюлозы. С ее помощью достигается практически дистиллированная чистота. Такие установки небольшие, они хорошо берегут энергию. Но есть и минус – из раствора убираются практически все микроэлементы, а они важны для жизнедеятельности.
Электродиализ
Экологичный способ обессоливания. Он основывается на том, что вещества (положительные и отрицательные ионы) притягиваются к электродам под воздействием электрического заряда.
Дистилляция
Это промышленная перегонка жидкости. В ходе нагрева образуется водяной пар. Он впоследствии охлаждается и собирается как конденсат.
Что влияет на норму?
Выделяют следующие факторы, влияющие на содержание магния, кальция, карбонатов, меняющих состав:
- Природа воды (водопроводная, дистиллированная, талая, родниковая, кипяченая).
- Состав водопроводной воды в определенной местности.
- Виды обитателей и продукты их метаболизма (рыбки, черепахи, водоросли).
- Период, за который не меняют воду, не очищают аквариум.
- Наличие или отсутствие фильтрации воды.
- Декор (гравий, крупные камни, замки).
- Наличие или отсутствие прямых солнечных лучей, падающих на растительность.
Даже если водопроводная вода в определенной местности обладает чрезмерными карбонатными показателями, их можно урегулировать
Это важно для аквариумов, где разводят дорогостоящие виды рыб
Жесткость и качество воды
Жесткая вода изменяет вкус воды. Порог, при котором соли отрицательно влияют на вкус, для кальция равен 2 – 6 мг – экв/л, для магния гораздо ниже. Если содержание ионов этих веществ в воде находится в пределах 1.6 – 3 мг – экв/л, то вода на вкус приятная.
Человек может употреблять воду, в которой показатель жесткости достигает 10 мг – экв/л, но недолгое время, потому что употребление ионов кальция с магнием отрицательно сказывается на здоровье.
Внимание! Жесткую воду нежелательно использовать в нагревательном оборудовании. Устройства, типа бойлера, электрочайника, стиральной либо посудомоечной машины, имеют встроенный для нагрева тэн, на котором появляется известковый налет, В результате перегрева тэна, приборы выходят из строя
Устройства, типа бойлера, электрочайника, стиральной либо посудомоечной машины, имеют встроенный для нагрева тэн, на котором появляется известковый налет, В результате перегрева тэна, приборы выходят из строя.
Чтобы избавится от накипи, надо использовать сухую лимонную кислоту, растворенную в воде. Данным раствором залить устройство и прокипятить. Далее нужно промыть оборудование и можно снова пользоваться.
Жесткая вода омрачает стирку, моющие средства в такой воде обильно вспениваются. Пена откладывает налеты на элементах в моющей и стиральной машинки, что также отрицательно сказывается на работе некоторых элементов устройства.
Внимание! Чтобы исключить вредное воздействие жесткой воды на организм, устанавливают многоступенчатые фильтры воды. Методы, которые позволяют измерить жесткость воды. Для того, чтобы приборы работали долго, а организм не страдал от показателя жесткости
Уровень содержания примесей в воде надо уметь определять. Определить превышение жесткости на вкус возможно, если показатель сильно превышает норму
Методы, которые позволяют измерить жесткость воды. Для того, чтобы приборы работали долго, а организм не страдал от показателя жесткости. Уровень содержания примесей в воде надо уметь определять. Определить превышение жесткости на вкус возможно, если показатель сильно превышает норму.
Для измерения используют следующие способы:
1.Если при растворении мыла в воде, оно не пенится, значит, показатель жесткости высокий, пить такую воду нельзя.
2.Если на тэне электрического чайника за короткое время появляется накипь, значит, вода очень жесткая.
3.Наиболее точным методом считается применение специальных полосок. Метод эффективный, но требует вложения денег. Полоску опускают в проверяемую жидкость на пару секунд, и она через минуту изменит цвет. Далее цвет соотносят с данными таблицы, которая имеется в инструкции.
Как определить жесткость воды с помощью домашнего прибора?
- Можно определить жесткость воды при помощи специального прибора, измеряющего электропроводность жидкости – TDS-метра.
При этом вы сможете узнать не только жесткость, но и наличие других примесей, электропроводность и даже температуру (в зависимости от фирмы). Главное – хорошая калибровка, желательно по 2-3 точкам. Цвет индикатора также меняется в зависимости от количества соли. К тому же солевой уровень непосредственно влияет и на электропроводность жидкости.
- Но есть также EC-метр. Он схож с предыдущим прибором, но помимо этого покажет удельное сопротивление раствора в мкСм/см (микросименс на см). Показания их немного отличаются из-за разности соотношений, поэтому используется формула при пересчете: TDS = k*EC, где k = 0,67, как средний коэффициент (в диапазоне 0,55-0,8).
- Есть приборы, объединяющие их свойства, но он достаточно дорогие, хоть и весьма точные. Подходят для определения воды в аквариуме или для чувствительных растений.

Определение