Правила составления окислительно-восстановительных реакций
Содержание:
- Химические свойства
- Химические свойства
- Хлориды железа
- Химические свойства
- Применение
- Методы получения
- Хлорное железо
- Применение хлорного железа в промышленности и коммунальном хозяйстве. Бытовое использование
- Химические явления при травлении плат. Меры безопасности
- Химические свойства железа
- Химические свойства цинка
- Применение
- Применение
Химические свойства
-
- 2FeCl3→2FeCl2+Cl2{\displaystyle {\mathsf {2FeCl_{3}\rightarrow 2FeCl_{2}+Cl_{2}}}}
За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
-
- FeCl3+Cl−→FeCl4−{\displaystyle {\mathsf {FeCl_{3}+Cl^{-}\rightarrow ^{-}}}}
При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
-
- FeCl3+Fe2O3→3FeOCl{\displaystyle {\mathsf {FeCl_{3}+Fe_{2}O_{3}\rightarrow 3FeOCl}}}
Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
-
- FeCl3+Cu→FeCl2+CuCl{\displaystyle {\mathsf {FeCl_{3}+Cu\rightarrow FeCl_{2}+CuCl}}}
- FeCl3+CuCl→FeCl2+CuCl2{\displaystyle {\mathsf {FeCl_{3}+CuCl\rightarrow FeCl_{2}+CuCl_{2}}}}
реагирует с иодоводородом:
-
- 2FeCl3+2HI→2FeCl2+I2+2HCl{\displaystyle {\mathsf {2FeCl_{3}+2HI\rightarrow 2FeCl_{2}+I_{2}+2HCl}}}
Химические свойства
При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
-
- 2FeCl3→2FeCl2+Cl2{\displaystyle {\mathsf {2FeCl_{3}\rightarrow 2FeCl_{2}+Cl_{2}}}}
За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
-
- FeCl3+Cl−→FeCl4−{\displaystyle {\mathsf {FeCl_{3}+Cl^{-}\rightarrow ^{-}}}}
При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
-
- FeCl3+Fe2O3→3FeOCl{\displaystyle {\mathsf {FeCl_{3}+Fe_{2}O_{3}\rightarrow 3FeOCl}}}
Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
-
- FeCl3+Cu→FeCl2+CuCl{\displaystyle {\mathsf {FeCl_{3}+Cu\rightarrow FeCl_{2}+CuCl}}}
- FeCl3+CuCl→FeCl2+CuCl2{\displaystyle {\mathsf {FeCl_{3}+CuCl\rightarrow FeCl_{2}+CuCl_{2}}}}
реагирует с иодоводородом:
-
- 2FeCl3+2HI→2FeCl2+I2+2HCl{\displaystyle {\mathsf {2FeCl_{3}+2HI\rightarrow 2FeCl_{2}+I_{2}+2HCl}}}
Хлориды железа

Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Самый простой способ получения хлоридов железа—это растворение металлического железа, закиси или окиси железа в соляной кислоте. Раствор FeCl2 получается также при травлении стальных изделий соляной кислотой.
Хлорное железо можно получить из хлористого хлорированием суспензии или раствора FeCl2 или окислением его кислородом воздуха. Получаемый раствор FeCU выпаривают до концентрации, при которой он при остывании затвердевает в кристаллический продукт FeCl3 • 6Н20.
Такой продукт получается и в качестве отхода от некоторых производств, в частности в производстве брома в процессе очистки бромо-воздушной смеси от примеси хлора раствором бромида железа.
Прямое получение хлоридов железа утратило свое значение в связи с развитием производства различных продуктов (TiCl4, А1С1з и др.) горячим хлорированием руд (см. гл. XL) с образованием значительных количеств хлоридов железа, являющихся побочными продуктами. В связи с ограниченностью потребности в них возникает необходимость дальнейшей их переработки с целью регене— рации хлора.
За границей все большее распространение получает изготовле — ‘ние безводного хлорного железа FeCl3 горячим хлорированием окиси железа или железной руды в присутствии восстановителя6’.
Хлористое железо получается при обработке материала, содержащего окись железа, смесью равных объемов хлористого водорода и водорода. Температура твердой фазы повышается в печи за счет тепла реакции от 260 до 650° 62,63. Описано получение безводного хлористого железа по реакции
2FeCl3+ С6Н, С1 = 2FeCl2+ СвН4С12 + НС1
Получаемая при хлорировании никелевой руды в присутствии восстановителя смесь FeCl2 и NiCl2 может быть разделена пропусканием через металлическое железо при 1200—1300°. При этом
Хлористый никель восстанавливается до металла и единственным газообразным продуктом является хлористое железо65.
Предложены разные способы регенерации хлора или хлористого водорода из отбросных хлоридов железа. При взаимодействии хлорного железа с воздухом при 600—800° образуются окись железа и хлор 66.
Выделение хлорида железа из отработанного солянокислого травильного раствора можно производить высаливанием его хлористым водородом.
Образующийся при этом солянокислотный раствор используется для травления металла67’68 (см. гл. XI).
Запатентован69 способ регенерации сернокислого травильного раствора насыщением его хлористым водородом (после упаривания). Образующаяся по реакции
FeS04 + 2НС1 = FeCl2+ H2S04
-серная кислота возвращается на травление, a FeCl2 подвергается гидротер. мической обработке для превращения в окислы железа и хлористый водород, возвращаемый на регенерацию травильного раствора. Гидролиз хлористого железа водяным паром по реакции 3FeCl2+ 4Н20 = Fe304 + 6НС1 + Н2 + 75,44 ккал
Целесообразно проводить при 450—650° (при 300° в равновесной газовой фазе содержится всего ~I% НС1). При 650° скорость гидролиза очень велика и реакция практически завершается за 15—20 мин70.
Хлорное железо может быть извлечено из солянокислых растворов (с целью их очистки от железа) некоторыми сложными эфирами и кетонами, в частности трибутилфосфатом 75 и диэтило — вым эфиром.
Сущность механизма экстракции заключается в изменении диэлектрической проницаемости водной фазы под влиянием кислот или солей, в результате чего работа отрыва молекул гидратированного хлорного железа становится равной работе сольватации их эфиром.
На основании этого высказано мнение, что появление в эфирной фазе HFeCl4 является вторичным процессом, не имеющим, вопреки установившимся взглядам, непосредственного отношения к механизму реакции 76.
При взаимодействии хлорита натрия с хлором происходит образование хлористого натрия и выделяется двуокись хлора: 2NaC102 + С12 = 2NaCl + 2 СЮ2 Этот способ ранее был основным для получения двуокиси …
Схемы с двухступенчатой аммонизацией
На рис. 404 представлена схема производства диаммонитро — фоски (типа TVA). Фосфорная кислота концентрацией 40—42,5% Р2О5 из сборника 1 насосом 2 подается в напорный бак 3, из которого она непрерывно …
СУЛЬФАТ АММОНИЯ
Физико-химические свойства Сульфат аммония (NH4)2S04 — бесцветные кристаллы ромбической формы с плотностью 1,769 г/см3. Технический сульфат аммония имеет серовато-желтоватый оттенок. При нагревании сульфат аммония разлагается с потерей аммиака, превращаясь в …
Химические свойства
-
- 2FeCl3→2FeCl2+Cl2{\displaystyle {\mathsf {2FeCl_{3}\rightarrow 2FeCl_{2}+Cl_{2}}}}
За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
-
- FeCl3+Cl−→FeCl4−{\displaystyle {\mathsf {FeCl_{3}+Cl^{-}\rightarrow ^{-}}}}
При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
-
- FeCl3+Fe2O3→3FeOCl{\displaystyle {\mathsf {FeCl_{3}+Fe_{2}O_{3}\rightarrow 3FeOCl}}}
Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
-
- FeCl3+Cu→FeCl2+CuCl{\displaystyle {\mathsf {FeCl_{3}+Cu\rightarrow FeCl_{2}+CuCl}}}
- FeCl3+CuCl→FeCl2+CuCl2{\displaystyle {\mathsf {FeCl_{3}+CuCl\rightarrow FeCl_{2}+CuCl_{2}}}}
реагирует с иодоводородом:
-
- 2FeCl3+2HI→2FeCl2+I2+2HCl{\displaystyle {\mathsf {2FeCl_{3}+2HI\rightarrow 2FeCl_{2}+I_{2}+2HCl}}}
Применение
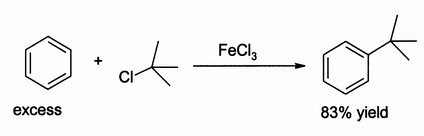
Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоте, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Методы получения
Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц:
-
- 2Fe+3Cl2→2FeCl3{\displaystyle {\mathsf {2Fe+3Cl_{2}\rightarrow 2FeCl_{3}}}}
Также трихлорид получается при окислении хлором хлорида железа(II):
-
- 2FeCl2+Cl2→2FeCl3{\displaystyle {\mathsf {2FeCl_{2}+Cl_{2}\rightarrow 2FeCl_{3}}}}
Также существует метод окисления оксидом серы(IV):
-
- 4FeCl2+SO2↑+4HCl→4FeCl3+S+2H2O{\displaystyle {\mathsf {4FeCl_{2}+SO_{2}\uparrow +4HCl\rightarrow 4FeCl_{3}+S+2H_{2}O}}}
Другим способом получения трихлорида железа (FeCl3) является взаимодействие оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
-
- Fe2O3+6HCl→2FeCl3+3H2O+Q↑{\displaystyle {\mathsf {Fe_{2}O_{3}+6HCl\rightarrow 2FeCl_{3}+3H_{2}O+Q\uparrow }}}
Хлорное железо
Безводное хлорное железо, выпускаемое химической промышленностью — FeCl3, — кристаллы темно-коричневого цвета с оттенками красного, фиолетового, темно-зеленого. Молярная масса — 162,21 г/моль. Плавится вещество при температуре 307,5 °C, при 500 °C начинает разлагаться. В 100 г воды растворяется навеска безводной соли:
- 74,4 г (0 °C);
- 99 г (25 °C);
- 315 г (50 °C);
- 536 г (100 °C).

Безводный хлорид железа (III) — очень гигроскопичное вещество, быстро притягивает влагу из окружающей среды. На воздухе взаимодействует с водой, превращаясь в желтые кристаллы гексагидрата FeCl3 + 6Н2О. Массовая доля безводного хлорного железа в веществе, приобретенном в торговой сети, достигает 95%. Присутствует небольшое количество хлористого железа FeCl2 и нерастворимых примесей. Торговое название — «Хлорное железо». Вещество пожаро- и взрывобезопасное, но его раствор оказывает коррозийное влияние на металлические предметы.
Применение хлорного железа в промышленности и коммунальном хозяйстве. Бытовое использование
Соли железа находят применения во многих сферах. Хлорид трехвалентного металла используется для обработки воды, металлов и закрепления красок. Вещество применяется в промышленном органическом синтезе (катализатор, окислитель). Особенно ценятся коагулирующие свойства иона Fe3+ в очистке коммунальных и производственных стоков. Под действием хлорида железа мелкие нерастворимые частички примесей слипаются и осаждаются. Также происходит связывание части растворимых загрязнений, которые удаляют на очистных сооружениях. Кристаллогидрат и безводная соль FeCl3 применяются в процессах травления металлических печатных форм. Добавляют вещество в бетон для укрепления его прочности.
Химические явления при травлении плат. Меры безопасности
Популярное химическое вещество для травления печатных плат — хлорное железо. Раствор для этих целей готовят из 0,150 кг соли и 0,200 л теплой воды. В нем содержатся ионы Fe3+, Cl–, а при гидролизе образуется соединение коричневого цвета — гидроксид трехвалентного железа. Процесс идет по схеме: FeCl3 + 3HOH Fe(OH)3 + 3Cl– + 3H+. Недостаток метода заключается в загрязнении платы побочными продуктами реакции, которые затрудняют дальнейшее травление. Сама соль — нелетучее вещество, но в процессе взаимодействия с водой выделяет едкие пары. Работу необходимо проводить на свежем воздухе или в хорошо проветриваемой комнате. Попадание раствора на кожу и слизистые оболочки приводит к раздражению и может вызвать дерматиты. Следует использовать средства индивидуальной защиты (очки, перчатки). При соприкосновении с едким раствором необходимо промыть кожу большим количеством воды.
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26Fe1s22s22p63s23p63d64s2, то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH)2 преобладают основные свойства, у оксида Fe2O3 и гидроксида Fe(OH)3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H2FeO4. Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину, имеющую формулу Fe3O4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe2O3. Реакция горения железа имеет вид:
3Fe + 2O2 =to=> Fe3O4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =to=> FeS
Либо же при избытке серы дисульфид железа:
Fe + 2S =to=> FeS2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F2 =to=> 2FeF3 – фторид железа (lll)
2Fe + 3Cl2 =to=> 2FeCl3 – хлорид железа (lll)
2Fe + 3Br2 =to=> 2FeBr3 – бромид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I2 =to=> FeI2 – йодид железа (ll)
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2Fe(OH)3 + 6HI = 2FeI2 + I2 + 6H2O
Fe2O3 + 6HI = 2FeI2 + I2 + 3H2O
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Взаимодействие со сложными веществами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H2SO4 (конц.) и HNO3 любой концентрации):
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
2Fe + 6H2SO4 = ot=> Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3 =ot=> Fe(NO3)3 + 3NO2 + 3H2O
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 оС). т.е.:
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d104s2. Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН)2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + H2O + O2 + CO2 → Zn2(OH)2CO3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900oC (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
4Zn + 10HNO3(0,5%) = 4Zn(NO3)2 + NH4NO3 + 3H2O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl2 = Cu + ZnCl2
Zn + FeSO4 = Fe + ZnSO4
Применение
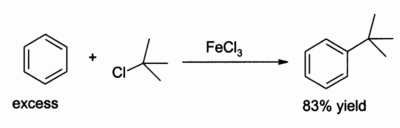
Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоты, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Применение

Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоты, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.