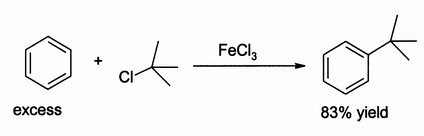Хлористое железо
Содержание:
Область применения хлорного железа
Хлорное железо
применяется в таких отраслях промышленности, как: очистные сооружения, водоканалы, металлообработка, химическая, пищевая, пивоваренная, кожевенная, нефтяная и т.д.
Основное применение раствора хлорида железа
приходится на очистку промышленных и сточных вод, в качестве первичного коагулянта. Под действием хлорида железа происходит физико-химический процесс укрупнения, слипания мелких частиц (коагуляция), что способствует выпадению из коллоидного раствора хлопьевидного осадка, либо образования геля, который, в дальнейшем, легко удаляется из очищаемых стоков. При очистке хлорным железом, количество нерастворимых примесей в сточных водах уменьшается до 95%, растворимых до 25%.
По сравнению с некоторыми коагулянтами хлорид железа
имеет ряд преимуществ, это:
- достаточно высокая скорость осаждения примесей.
- положительное действие на биохимическое разложение осажденных примесей, активного ила.
- более низкая стоимость по сравнению с другими распространенными коагулянтами.
Так же хлорид железа
используют:
- в качестве катализатора в процессах органического синтеза.
- для травления металлов (печатных плат, печатных форм)
- как протрава при крашении ткани.
- как добавку для повышения прочности бетона.
Метки
Автоматизированный электроприводКомплектный электроприводСистема управленияСистемы управления комплексамиТехнические средства комплексовХарактеристика оборудованияЭлектроприводЭлектроприводы постоянного токаЭнергетические сетиавтоматизированные электроприводыагрегатгенераторгруздавлениедвигательжидкостьканалклапанкомплексконтактконтролькорпускранлебедкамеханизммодель механизмнагрузкапередачаполостьпреобразователь скоростиприводрапсрапсароторрычагсемянсистемастреласхематрансмиссияукрагроконсалтхарактеристика электроприводашассишестерняэлектропривод переменного тока
Хлорид железа и коагулянт
Хлорное железо — средняя соль трехвалентного железа и соляной кислоты. На вид это химическое сырье представляет собой мягкую кристаллическую массу ржаво-коричневато-черного цвета. Температура его кипения составляет 319°С, температура плавления — 309°С. Хлорное железо образуется в результате нагревания железа с хлором. Его можно получить также как побочный продукт при производстве хлорида титана TiCl4 и хлорида алюминия AlCl3. Еще один способ получения хлорного железа – горячее хлорирование или окисление раствора FeCl2 с последующим выпариванием раствора FeCl3.
Сфера применения хлорного железа достаточно широка. Его используют как коагулянт для очистки воды, как катализатор в органическом синтезе, как протраву в процессе окрашивания тканей, а также для приготовления железных пигментов и прочих солей железа. Еще раствор хлорного железа используют для травления печатных плат.
Достаточно широкое распространение хлорное железо получило в качестве коагулянта в процессе очистки промышленных и городских сточных вод
По сравнению с другими коагулянтами, в частности с сернокислым алюминием, этот химический продукт имеет важное преимущество – хлорид железа наделен высокой скоростью осаждения разнообразных примесей. В результате гидролиза хлорное железо образует малорастворимый гидроксид железа
В процессе его образования захватываются различные органические и неорганические примеси, образуя при этом рыхлые хлопья, которые легко удаляются из очищаемых стоков. Такие хлопья, плотностью 1001–1100 г/л и размером 0,5–3,0 миллиметров, имеют довольно большую поверхность с отличной сорбционной активностью. В процессе их образования в структуру включаются взвешенные вещества (крупные микроорганизмы, клетки планктона, ил, остатки растений), коллоидные частицы, а также часть ионов загрязнений, ассоциированных на поверхности данных частиц. При помощи данного продукта процесс осаждения шлама протекает намного быстрее и глубже. Еще одно преимущество хлорного железа — его благоприятное влияние на биохимическое разложение шлама. Для качественной очистки сточных вод на один кубический метр требуется 30 г хлорного железа. Очистка вод хлорным железом уменьшает содержание растворимых примесей до 25 процентов, а нерастворимых до 95 процентов. В процессе проведения очистки сточных промышленных и городских вод ядовитые соединения и микроорганизмы разрушаются гипохлоритом натрия.
Благодаря своим ярко выраженным кислотным свойствам хлорид железа используется как катализатор в процессах органического синтеза, при получении термостойких смол и окисления нефтяных битумов. Железо хлорное — энергичный хлорирующий агент, поэтому он применяется для избирательного извлечения некоторых компонентов руд. В частности, это химическое сырье требуется в ароматических углеводородах для реакции электрофильного замещения. Хорошо известно также применение водных растворов хлорного железа. Обладая достаточно мягкими травильными свойствами, они используются в электронной промышленности и приборостроении для травления печатных плат, металлических деталей и медной фольги. Применяется хлорное железо и в строительстве. Его используют как добавку к портландцементу для ускорения процесса схватывания. Добавка хлорного железа значительно увеличивает прочность бетона. Используется этот продукт и в других сферах жизнедеятельности человека, в частности: • с его помощью осветляются природные воды в системах водоподготовки; • удаляется масло из стоков масложировых комбинатов; • он используется при очистке сточных вод кожевенно-меховых предприятий от соединений хрома; • для смягчения хозяйственно-питьевой воды; • а также в хлорорганическом синтезе
Область применения хлорного железа
Хлорное железо применяется в таких отраслях промышленности, как: очистные сооружения, водоканалы, металлообработка, химическая, пищевая, пивоваренная, кожевенная, нефтяная и т.д.
Основное применение раствора хлорида железа приходится на очистку промышленных и сточных вод, в качестве первичного коагулянта. Под действием хлорида железа происходит физико-химический процесс укрупнения, слипания мелких частиц (коагуляция), что способствует выпадению из коллоидного раствора хлопьевидного осадка, либо образования геля, который, в дальнейшем, легко удаляется из очищаемых стоков. При очистке хлорным железом, количество нерастворимых примесей в сточных водах уменьшается до 95%, растворимых до 25%.
По сравнению с некоторыми коагулянтами хлорид железа имеет ряд преимуществ, это:
- достаточно высокая скорость осаждения примесей.
- положительное действие на биохимическое разложение осажденных примесей, активного ила.
- более низкая стоимость по сравнению с другими распространенными коагулянтами.
Так же хлорид железа используют:
- в качестве катализатора в процессах органического синтеза.
- для травления металлов (печатных плат, печатных форм)
- как протрава при крашении ткани.
- как добавку для повышения прочности бетона.
Травление нержавеющей стали

Травление нержавеющей стали – немаловажный процесс, который обеспечивает удаление верхнего слоя материала и восстановление первоначального состояния.
Суть в том, что после проведения определённых работ на поверхности нержавейки могут образоваться дефекты в виде сварных швов, оксидов и окалин, которые способны заметно подпортить внешний вид материала, а также ухудшить эксплуатационные и эстетические свойства. Отличительной чертой стали считается наличие оксидохромовой пленки, целью которой является защита верхнего слоя.
Именно из-за неё и возникают вышеперечисленные дефекты, которые с трудом вступают в связь с реагентами. В случае возникновения таких неприятностей можно исправить ситуацию, воспользовавшись специальной процедурой – травление нержавеющей стали.
Процедура травления нержавеющей стали
Химическая и электрохимическая обработка или травление считается одним из лучших способов очистки верхнего слоя нержавейки.
Данная процедура отлично очищает поверхность стали от сварных швов, устраняет деформации различного типа, а также способствует укреплению структуры сплава после термической обработки.
Кроме очистных свойств, процедура обеспечивает восстановление пассивного слоя стали, необходимого для защиты сплава от разрушения структуры при повышенных температурах.
В основном используются соляная либо серная кислоты, после чего в ход вступает смесь расплавленной щелочи.
Процесс очистки кислотой имеет две стадии: в первую очередь металл обрабатывается основным кислотным составом, а в заключении сплав выдерживается в ванне с раствором азотной кислоты.
Обрабатывая нержавейку, стоит строго соблюдать этапы технологического процесса. Емкость с раствором, в которую помещен сплав, должна обрабатывать лишь верхние слои металла, дополнительно устраняя имеющиеся повреждения. Не рекомендуется допускать изменение макроструктуры нержавеющей стали, так как железо может потерять свои первоначальные свойства.
Методы получения
-
- 2Fe+3Cl2→2FeCl3{\displaystyle {\mathsf {2Fe+3Cl_{2}\rightarrow 2FeCl_{3}}}}
Также трихлорид получается при окислении хлором хлорида железа(II):
-
- 2FeCl2+Cl2→2FeCl3{\displaystyle {\mathsf {2FeCl_{2}+Cl_{2}\rightarrow 2FeCl_{3}}}}
Также существует метод окисления оксидом серы(IV):
-
- 4FeCl2+SO2↑+4HCl→4FeCl3+S+2H2O{\displaystyle {\mathsf {4FeCl_{2}+SO_{2}\uparrow +4HCl\rightarrow 4FeCl_{3}+S+2H_{2}O}}}
Другим способом получения трихлорида железа (FeCl3) является взаимодействие оксида железа(III) с соляной кислотой, сопровождающееся выделением воды и энергии в виде тепла:
-
- Fe2O3+6HCl→2FeCl3+3H2O+Q↑{\displaystyle {\mathsf {Fe_{2}O_{3}+6HCl\rightarrow 2FeCl_{3}+3H_{2}O+Q\uparrow }}}
Хлористое железо
Хлористое железо переходит в водный раствор, а выделяющийся сероводород вновь реагирует с железом.
Хлористое железо образуется при добавлении в реакционную массу соляной кислоты. Эти данные были использованы в промышленности.
Хлористое железо РеС12 — 4Н2О — прозрачные голубоватые кристаллы, зеленеющие на воздухе вследствие частичного окисления. Эти кристаллы очень хорошо растворимы в воде; во влажном воздухе расплываются.
Хлористое железо можно получить растворением чистого железа в концентрированной соляной кислоте при нагревании, причем берут избыток железа, чтобы избежать окисления получающейся соли.
|
Диагональный разрез систем SnCb — f Fe ( слева и Fed. — j — Sn ( справа. |
Хлористое железо в расплавленном состоянии реагирует с металлическим оловом, образуя металлическое железо, сплавы железа с оловом и хлористое олово.
Хлористое железо FeCl2 образует с хлористым алюминием химическое соединение Fe ( AlCl4) 2 или РеС12 — 2А1С13, инконгруэнтно плавящееся при 193 С.
Хлористое железо РеС12 образуется в виде зеленовато-серых гексагональных кристаллов с плотностью 2 98 г / см3; на воздухе они желтеют вследствие окисления. Образует кристаллогидраты с 1 2, 4 и 6 молекулами воды.
Хлористое железо получается при обработке материала, содержащего окись железа, смесью равных объемов хлористого водорода и водорода.
Хлористое железо в производственных условиях получают путем растворения в соляной кислоте ( до насыщения) стружки малоуглеродистых сталей марки 10 или 20, предварительно обезжиренной в 10 % — ном растворе каустической соды при температуре 60 — 70 С, затем промытой горячей водой. После отстоя в течение 15 — 20 ч раствор сливают в рабочую ванну.
Хлористое железо получается в реакционной массе при растворении чугунной стружки е соляной кислоте, которая часто вводится в реакционную массу не в свободном виде, а вместе с анилином в виде солянокислого анилина.
Хлористое железо получается в реакционной массе при растворении чугунной стружки — в соляной кислоте, которая часто вводится в реакционную массу не в свободном виде, а вместе с анилином в виде солянокислого аншшша.
Хлористое железо, нелетучее при температуре перегонки, остается в реторте.
Хлористое железо можно заменить непосредственно хлорным железом ( при этом, однако, снижается выход), так как раствор натриевого производного циклопентадиена восстанавливает хлорное железо.
Хлористое железо РеС12 — 4Н2О — прозрачные голубоватые кристаллы, зеленеющие на воздухе вследствие частичного окисления. Эти кристаллы очень хорошо растворимы в воде; во влажном воздухе расплываются.
Применение
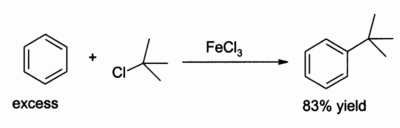
Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоте, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Используется в кузнечном деле для проявления рисунка железа.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Упаковка, Транспортировка и хранение хлорного железа
Транспортируют любым видом транспорта в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта.
Перевозят раствор в стальных гуммированных железнодорожных или автомобильных цистернах, а так же в специальных контейнерах вместимостью до 1000 дм3.
Хлорид железа должен храниться в гуммированных, титановых или полиэтиленовых емкостях.
В холодное время года, хранение продукта производится в закрытых складских помещениях с соблюдением температурного режима.
Гарантийный срок хранения — один год со дня изготовления.
Обязательной сертификации не подлежит.
Химические свойства
-
- 2FeCl3→2FeCl2+Cl2{\displaystyle {\mathsf {2FeCl_{3}\rightarrow 2FeCl_{2}+Cl_{2}}}}
За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
-
- FeCl3+Cl−→FeCl4−{\displaystyle {\mathsf {FeCl_{3}+Cl^{-}\rightarrow ^{-}}}}
При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
-
- FeCl3+Fe2O3→3FeOCl{\displaystyle {\mathsf {FeCl_{3}+Fe_{2}O_{3}\rightarrow 3FeOCl}}}
Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
-
- FeCl3+Cu→FeCl2+CuCl{\displaystyle {\mathsf {FeCl_{3}+Cu\rightarrow FeCl_{2}+CuCl}}}
- FeCl3+CuCl→FeCl2+CuCl2{\displaystyle {\mathsf {FeCl_{3}+CuCl\rightarrow FeCl_{2}+CuCl_{2}}}}
реагирует с иодоводородом:
-
- 2FeCl3+2HI→2FeCl2+I2+2HCl{\displaystyle {\mathsf {2FeCl_{3}+2HI\rightarrow 2FeCl_{2}+I_{2}+2HCl}}}
Хлорное железо — коагулянт для очистки воды
Преобладающее количество производимого хлорного железа употребляется для чистки промышленных и сточных вод.
Неувязка чистки промышленных и сточных вод является одной из важных задач охраны среды.
Коагуляция – один из распространённых способов чистки сточных вод. Суть способа коагуляции заключается во содействии веществ, загрязняющих стоки, с минеральными коагулянтами. В качестве коагулянтов в большинстве случаев употребляют хлорное железо, которое в итоге гидролиза образует плохорастворимый гидроксид железа Fe(OH)3. В процессе образования данного гидроксида захватываются неорганические и органические примеси с образованием рыхловатых хлопьев, которые можно просто удалить из очищаемых стоков. Образующиеся хлопья размером 0,5–3,0 мм и плотностью 1001–1100 г/л имеют очень огромную поверхность с неплохой сорбционной активностью. В процессе их образования и седиментации в структуру врубаются взвешенные вещества (ил, клеточки планктона, большие мельчайшие организмы, остатки растений и т. п.), коллоидные частички и та часть ионов загрязнений, которые ассоциированы на поверхности этих частиц. Высочайшая скорость осаждения хлопьев гидроксида обуславливает преимущество хлорного железа перед сернокислым алюминием. Процесс осаждения шлама с помощью хлорного железа протекает резвее и поглубже, не считая того, хлорное железо положительно влияет на биохимическое разложение шлама. Расход хлорного железа составляет 30 г на куб. метр сточных вод. Хим чистка сточных вод уменьшает содержание нерастворимых примесей до 95% и растворимых до 25%.
При проведении чистки сточных вод мельчайшие организмы и ядовитые соединения, находящиеся в водах, разрушаются гипохлоритом натрия.
Гипохлорит натрия можно использовать для обработки сточных вод, содержащих соли аммония, фенольные соединения, ртуть. Степень чистки добивается 99,9%.
В итоге проведенных исследовательских работ эффективности используемых в пищевой индустрии антисептических средств гипохлорит натрия был оценен как более действенный и экономный продукт. Он показал высшую эффективность воздействия на фактически все виды растительных клеток, спор и микробов.
Обычно употребляют раствор с содержанием 30 – 40 мг/л активного хлора.
Хлорное железо используют также в качестве катализатора в процессах органического синтеза, окисления нефтяных битумов, при получении теплостойких смол. Он является энергичным хлорирующим агентом, потому может употребляться для избирательного извлечения отдельных компонент руд.
Водные смеси хлорного железа владеют мягенькими травильными качествами, потому их используют для травления печатных плат, медной фольги и железных деталей перед нанесением гальванических покрытий.
Отлично понятно применение хлорного железа в качестве добавки к портландцементу для ускорения процесса схватывания. Водоцементное отношение (В/Ц) рекомендуется в границах 0,4 – 0,5. Добавка хлорного железа позволяет увеличивать значение В/Ц. Добавка хлорного железа увеличивает крепкость бетона.
Технические свойства раствора хлорного железа.
1. Массовая толика хлорного железа — более 40 %;
2. Плотность раствора при 20 °С — более 1,41 г/куб. см;
3. Массовая толика хлористого железа — менее 1 %;
4. Массовая толика нерастворимых в воде веществ — менее 2 %;
5. Массовая толика соляной кислоты – менее 1,5 %.
Нормативная документация: ТУ 2152-081-56856807-08
Путь: Автоматизированный электропривод > Промышленные сегодня > Хлорное железо — коагулянт для очистки воды