Принцип работы батарейки
Содержание:
- Как устроена батарейка
- Современные батарейки
- ЗАРЯЖАЕМЫЕ БАТАРЕЙКИ
- Что такое солевые батарейки
- ПРЕИМУЩЕСТВА И НЕДОСТАТКИ
- Что такое алкалиновая (щелочная) батарейка
- История создания
- Как изготавливают батарейки
- Солевые батарейки
- Как работает батарейка
- Как работает аккумуляторная батарейка, её отличие от обычной
- Ключевые преимущества
- Что такое солевые батарейки
Как устроена батарейка
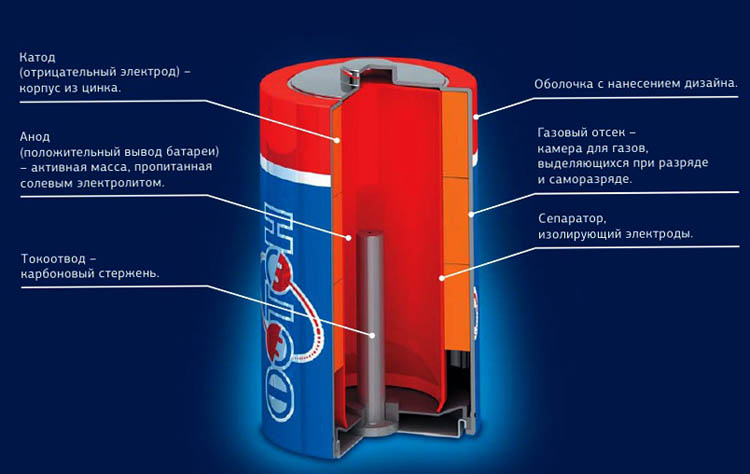
Внутри металлического корпуса щелочной ячейки находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.
Щелочная батарейка. /Роджер Кларк
Это может показаться сложным, но способ производства электричества в батарейке на самом деле довольно прост: происходит химическая реакция, которая перемещает крошечные отрицательно заряженные частицы, называемые «электронами», вокруг, чтобы создать электрический ток.
Когда элемент подключен к цепи – например, к лампочке, – цинк внутри реагирует с диоксидом марганца и теряет электроны.
Электроны собираются с помощью металлического стержня внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательный), через провода к лампе (чтобы она загорелась), а затем обратно в верхнюю часть ячейки. (положительный).
Эта реакция производит около 1,5 вольт электроэнергии. Поскольку не так много устройств могут работать при напряжении 1,5 В, очень часто два или четыре элемента используются вместе для увеличения мощности. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
Источник Shutterstock
Когда большая часть цинка прореагировала с диоксидом марганца, мы говорим, что элемент «плоский», что означает, что он больше не может производить электричество. Поскольку химическая реакция, происходящая в щелочных элементах, не может быть легко изменена, это означает, что элемент не может быть перезаряжен.
Но помните, что большинство элементов и батарей можно утилизировать, поэтому убедитесь, что вы тщательно от них избавились.
Современные батарейки
С момента появления гальванических элементов прошло много времени, их внешний вид сильно изменился. Несмотря на перемены, принцип работы таких элементов питания остался прежним. Они по-прежнему состоят из двух электродов (анод, катод) и электролита.
С распространением первых компактных электроприборов и накоплением опыта использования батареек стали видны их преимущества и недостатки. Они были громоздкими, много весили, случались потери электролита, окисление электродов, а также скапливание соли. Началась эволюция батареек, продолжающаяся и сегодня. Элементы питания разделились на два больших класса — первичные, к которым относят гальванические элементы, и вторичные, — чаще их называют аккумуляторами. Реакции, протекающие в первичных, необратимы, в конце концов они теряют весь заряд и подлежат утилизации. Вторичные позволяют восстанавливать заряд после разрядки и повторно использовать элемент питания, цикл которого повторяется много раз.

Также элементы питания различают по типу материалов, используемых для электродов, и виду электролитов. По виду католита различают солевые и щелочные, или алкалиновые, батарейки. Что это такое, рассмотрим более подробно. Электрод, как правило, изготавливают из металла, но есть и другие способы. Долгое время в качестве электродов и электролитов пробовались разные металлы и материалы. Одни вышли из употребления из-за высокой стоимости, другие из-за токсичности (ртутные), третьи имели низкую надёжность. Но многие типы батареек остались в употреблении и используются до сих пор. Почему так происходит? Всё дело в разнообразии электроприборов — разные устройства имеют различные требования к источнику питания.
Одни элементы питания очень дёшевы и просты в изготовлении, например солевые батарейки в часах или пульте дистанционного управления. Они работают с небольшой нагрузкой и требования к ним минимальны. Для других важна надёжность — это автомобильные аккумуляторы, источники бесперебойного питания. Однако из-за громоздкости и большой массы их применение ограничивается транспортом и стационарными устройствами. Также необходимо сочетание надёжности и компактности для современных мобильных телефонов и ноутбуков.
ЗАРЯЖАЕМЫЕ БАТАРЕЙКИ

Заряжаемая щелочная батарейка, габарит АА.
Существуют способы подзарядки щелочных батареек, продлевающие их срок службы, но производителями такие действия не рекомендуются, результат подзарядки может быть самым непредсказуемым. Возможность небольшой зарядки щелочных батареек дает обратимость электрохимической реакции, протекающей при разряде, но конструкция не обеспечивает безопасную зарядку. Поэтому были разработаны специальные перезаряжаемые щелочные батареи, получившие названия полуторавольтовые аккумуляторы, заряжаемые щелочные батарейки или RAM (Reusable Alkaline Manganese, Rechargeable Alkaline Manganese – многократно используемые щелочные марганцевые), исключающие утечку электролита или разгерметизацию которые могут произойти при многократной перезарядке. Патент на первое поколение таких батареек был получен в Канаде. Их выпуск был начат в конце восьмидесятых годов.
К неоспоримым преимуществам следует отнести возможность приобретения химического источника питания готового к работе без предварительной зарядки. Если после приобретения аккумулятора его нужно вначале зарядить, а потом использовать, то заряжаемые батарейки можно сразу устанавливать бытовую технику, не имея под рукой зарядного устройства. Приобретая заряжаемую батарейку, мы получаем первичный источник тока. После первого разряда батарейку можно зарядить и она становится вторичным источником тока. Таким образом, заряжаемые батарейки занимают промежуточное положение между первичными и вторичными источниками тока. Напряжение батарейки составляет 1,5 вольта и почти не меняется до полного разряда. Эти батарейки могут работать в режиме разрядных токов до 600 миллиампер. Емкость батарейки габарита АА достигает 2 ампер-часа. Их внутренне сопротивление выше, чем внутреннее сопротивление обычных батареек. Активные вещества цинк и оксид марганца. Перезаряжаемые щелочные батарейки являются хорошей заменой никель-кадмиевых и никель-магниевых аккумуляторов. В заряженном состоянии заряжаемые батарейки могут храниться несколько лет. Цена заряжаемых батареек в два раза выше цены обычных щелочных, но ниже цены аккумуляторов. Длительный срок хранения, превосходящий показатели никель-кадмиевых, никель-магниевых аккумуляторов, отсутствие вредных веществ позволяет заряжаемым щелочным батарейкам составить конкуренцию аккумуляторам, применяемым в бытовой технике.
Если батарейки разряжены менее чем на 25 %, то они могут перезаряжаться несколько сот раз до напряжения величиной 1,42 вольта, если они разряжены более чем на 25 % и менее чем на 50 %, то возможен перезаряд до 50 раз до напряжения уровнем 1,32 вольта. Сильно разряженная батарейка может перезаряжаться не более 20 раз. Батарейки могут использоваться в любом устройстве, которое поддерживает стандартные габариты (AA, AAA, C, D, и другие). Батарейки этого типа более всего подходят для устройств с низким потреблением тока в дежурном режиме, которые используются периодически. Например: пульты дистанционного управления, портативные радиостанции, карманные фонарики и другие. В некоторых странах заряжаемые батарейки получили широкое распространение. Есть бытовые приборы, в которых они рекомендованы в инструкциях. Некоторые приборы, ориентированные на этот тип батареек оснащены блоком питания, обеспечивающим два варианта зарядки – аккумулятор или батарейка. Блок питания таких приборов, рассчитанных на габарит АА, поддерживает зарядный ток в диапазоне 10…20 миллиампер для исключения последствий из-за возможной путаницы между заряжаемыми батарейками и обычными. При низких температурах эти батареи подходят только для маломощных устройств.
Щелочные батарейки имеют множество преимуществ перед батарейками других типов. Это позволило им завоевать популярность во всем мире.
Что такое солевые батарейки
Солевые батарейки встречаются практически везде. Это недорогие изделия разного вольтажа, для утилизации которых не требуется какое-либо особое оборудование. В нормальном, сухом помещении такие батарейки могут храниться не менее двух лет.
Солевая батарейка состоит из:
- Плюсового марганцевого анода.
- Минусового цинкового катода.
- Электролита – хлорида цинка, или как его называют проще – соли. Отсюда и пошло название.
Ещё одно конструктивное отличие от алкалиновых источников питания – минусовой катод цилиндрической формы. Подобная особенность каких-либо технических улучшений не предусматривает, но всё же.
Из минусов: ухудшение работы и снижение эксплуатационного срока при функционировании в условиях пониженной температуры. Поэтому устанавливать солевые батарейки лучше всего в приборы, которые постоянно находятся в тепле. Для того, чтобы подлить срок эксплуатации солевого источника питания, его необходимо периодически отключать от потребителя и следить, чтобы он не перегревался.
ПРЕИМУЩЕСТВА И НЕДОСТАТКИ
Благодаря особенностям конструкции щелочная батарейка имеет преимущества и недостатки. Главным преимуществом является увеличенный ток разряда. По сравнению с солевыми батарейками щелочные имеют значительно увеличенный срок службы благодаря большому запасу реагентов. Срок хранения также увеличился и может составлять несколько лет. После года хранения емкость снижается не более чем на 10 %. Батарейки хорошо работают в широком температурном диапазоне. При работе напряжение батарейки долгое время не изменяется и только в конце срока службы резко уменьшается.
Щелочные батарейки дороже солевых, их вес больше из-за особенностей конструкции. Способы восстановления солевых батареек неприменимы к щелочным батарейкам. Так как емкость щелочных элементов питания существенно превышает емкость солевых, то их необходимо использовать в устройствах со средним и высоким потреблением энергии. Это электробритвы, плееры, диктофоны, а также фотовспышки и мощные фонари.
Что такое алкалиновая (щелочная) батарейка
Алкалиновая батарейка также состоит из анода – порошкообразный цинк, катода – диоксид марганца и электролита, в качестве которого выступает гидроксид калия, который является щелочью. Следовательно, отсюда идет название и самих батареек. Алкалиновыми батарейки стали называть только потому, что на английский язык щелочь переводится как Alkaline, и на многих батарейках зарубежного производства есть эта надпись.
Алкалиновая батарейка
Принцип работы у алкалиновых батареек такой же, как и у солевых. Химические элементы анода и катода аналогично взаимодействуют посредством электролита, а вырабатываемый ток передается устройствам через токоотводы.
Появились такие батарейки в 1959 году благодаря изысканиям и научным разработкам Льюиса Урри. Напряжение 1,5 В. Стандартные размеры батареек АА и ААА, LR 14, LR 20, 6F22.

Преимущества алкалиновой батарейки:
- Большая емкость.
- Хорошо работают при средних нагрузках.
- Могут работать при низких температурах.
- Надежная герметизация.
- Низкий показатель саморазряда.
- Срок хранения до 7 лет.
Недостатки:
- Высокая цена.
- Более тяжелые.
- Когда ресурс выработан, мгновенно «умирают».
Алкалиновые батарейки применяются там, где нужно среднее и высокое токопотребление, например:
- Мощные фонари.
- Аудиоплееры.
- Диктофоны.
- Фотоаппараты и фотокамеры.
- Пульты от сигнализации.

Пальма первенства среди фирм производителей таких батареек принадлежит американским компаниям Duracell и Energizer, за ними следуют японские Sony и Toshiba.
Что общего у солевых и алкалиновых батареек
- Имеют одинаковый стандартный размер.
- Могут быть использованы в одних и тех же устройствах (но солевые выйдут из строя очень быстро).
- Одинаковое напряжение.
- И те и другие батарейки нельзя подзаряжать, это может привести к их взрыву.
- Оба типа батареек, после использования необходимо правильно утилизировать.

Сегодня все больше стран уделяют внимание утилизации солевых и алкалиновых батареек. Большинство развитых государств создают специальные пункты приема, куда можно отнести использованные элементы, а при покупке новых даже получить скидку
Батарейки отправляются на специальные заводы, где из них извлекают опасные металлы и химические соединения, для вторичной переработки. Если этого не делать, токсичные вещества могут попасть в землю, воду, а при сжигании мусора и в воздух, а это чревато, в свою очередь, серьезными последствиями для всех живых организмов на планете.
История создания
Исследования по изучению перезаряжаемых аккумуляторных батарей на основе натрия в качестве отрицательного электрода начались ещё в 60-х годах прошлого века
Натрий привлек внимание учёных в первую очередь из-за своего большого электрического потенциала -2,71 В, лёгкого веса, нетоксичности и дешевизны.Наиболее известная батарея на основе натрия — это натриево-серная батарея (NaS), которая выпускается японской корпорацией NGK. Никелево-солевые аккумуляторы являются логическим продолжением натриево-серной технологии, при этом они лишены недостатков, присущих натриево-серным батареям, а именно не содержат в своем составе едкой серы, которая ввиду своих свойств способствует быстрой коррозии керамики и тем самым сокращает срок службы аккумулятора.Никелево-солевые батареи были впервые испытаны в 1970-х годах группой учёных в рамках проекта Zeolite Battery Research Africa (ZEBRA) в Претории, ЮАР под руководством доктора Йохана Котзера
По сокращённому названию проекта батарея и получила название Zebra. В течение 1980-х группой Beta Research and Development of Derby, Великобритания были полностью описаны химия элементов, электрохимические процессы, а также описан производственный цикл.В течение 20 лет группа учёных доводила технологию до совершенства, испытывая в активном веществе присадки из разных металлов для достижения наибольших показателей производительности.Серийное производство никелево-солевых батарей для разных отраслей промышленности было налажено в 1998 году в Швейцарии в г. Стабио на заводе MES-DEA. Сегодня данное предприятие входит в группу FIAMM и выпускает батареи для энергетики, связи, систем накопления энергии.
Как изготавливают батарейки
Производство элементов питания выглядит следующим образом:
- Из стали нарезают пластинки овальной формы.
- Подготовленные элементы сворачивают в трубочку, которая в дальнейшем будет выполнять роль корпуса устройства.
- В трубочку помещают все химические элементы: графитовый стержень, электролит, цинковый порошок, загуститель, катализатор и другие.
- Следующий шаг — изготовление катода. Для этого специальный пресс «скатывает» необходимые химические соединения.
- На капсулу будущей батарейки наносится бороздка. Она необходима, чтобы упростить процесс спайки.
- На минусовой полюс наносят герметик и клей, который высыхает, пока устройство перемещается по ленте конвейера.
- Внутрь корпуса вливается электролит, а в полость анода — гель, изготовленный из цинка. Он придаёт электролиту серебристо-серый оттенок.
- Чтобы зарядить устройство, к его нижней части «приваривают» гвоздь длиной 4 см.
- Далее запаивают отрицательный контакт.
- Чтобы устройство приняло окончательный вид, все края корпуса загибают.
- Последний этап — проверка работоспособности и нанесения необходимой маркировки.
Оборудование для производства батареек
Для производства элементов питания на заводах используют различные автоматизированные установки. Состав линии может меняться, но в большинстве случаев в неё входят:
- вибрационный станок;
- машина, изготавливающая корпус;
- станок, разделяющий линию;
- автомат для сборки;
- сборочная станция;
- специальная «тарелка».
Солевые батарейки
Первый прототип появился благодаря «полёту мысли» изобретателя итальянского происхождения Алессандро Вольта в далёком 1800 году. Это был прообраз современной солевой батарейки. Он просто взял да и объединил в одно целое несколько цинковых и серебряных дисков с картоном, которые пропитал в растворе соли. А уж потом учёные всего мира совершенствовали эту технологию и внешний вид устройства.
Двадцать лет спустя британским учёным Джоном Даниэлем было представлено изделие, где в качестве электролита применялся сульфат цинка и меди. Мощность этого изделия равнялась 1,1 вольта, однако, если применять их в приборах, требующих не так много электроэнергии, их заряда хватило бы на сто лет эксплуатации.

Особенности состава и конструкции
Длительный период этот элемент питания опережал остальные по востребованности, этому не мешало даже то, что батареи практически не изменились с момента своего создания ни внешне, ни внутренне. Великолепно сочетая в себе качественные характеристики и недорогую стоимость, они уверенно лидировали по продажам.
Внутренняя часть очень проста. Основу батареи составляет анод, который представлен в виде порошкового цинка. Диоксидом марганца пропитана активная часть элемента питания. К катоду, изготовленному из цинка, добавили антикоррозионные элементы и, естественно, электролит, роль которого выполняет хлорид аммония. По сути, именно хлорид аммония и дал название батарейке, так как электролитом в ней является не что иное, как соль.
Электроды элемента разделяют прокладки, они отделяют реагент, не позволяя ему соприкасаться, но в то же время не препятствуют проникновению электролита. Как результат, внутри начинает протекать реакция, которая и является причиной возникновения электрического тока. Он поступает на установленные внутри питательные элементы, а через них и на электроды, продолжая своё движение к устройству, в которое и помещена батарейка.
Виды и габариты
В мире электроники имеется огромное количество всевозможных видов солевых батарей. Все эти типы и размеры давно обзавелись собственным обозначением. Дело в том, что было решено — различить их будет намного проще, если наносить на них маркировку из букв и цифр. Такое решение родилось в недрах международной электротехнической комиссии, но помимо этого, аналогичные классификации имеются и в нашем отечественном ГОСТ, ТУ, а также в импортном ANSI/NEDA.
Все мы давно привыкли к двум видам батареек, которые легко отличаются даже внешне. Это пальчиковые и мизинчиковые батарейки. В соответствии с классификацией им присвоены обозначения АА и ААА соответственно. И у той и у другой напряжение соответствует 1,5 вольта. Форма батареек имеет вид вытянутого цилиндра.
Но помимо этих двух, в магазинах встречаются ещё три разновидности. Очень часто можно видеть батарейки, классифицируемые как C или LR 14. Выглядят они как небольшой бочоночек.
Более крупные батарейки (также в виде бочонка, но уже крупнее) в своё время выпускали специально для фонарей. Маркировку они получили D или LR 20, но кроме как в фонарях, они прекрасно помещались и в магнитофонах.
Во времена Союза был налажен выпуск батарей R10. Нашли они своё применение в различных приборах для измерений и… в игрушках.
Если присмотреться к цилиндрообразным батарейкам, то с одного конца можно заметить выступ, в этом месте располагается плюс батарейки. На другом конце нет никаких выступов, а раз их нет — значит это её минус. А в батарейке прямоугольной формы 6 F22, или как её называют в народе, крона, на верхней части имеется сразу два выступа. И плюс и минус вынесены в одно место.

Плюсы и минусы
Если говорить о хорошем и плохом, нужно признать, что плюсы солевых элементов питания — лёгкость и низкая стоимость. Это основные их козыри. Если не эксплуатировать их нещадно, а иногда давать перерыв, то прослужат они немного дольше. Даже если они сели, их можно ненадолго реанимировать, основательно встряхнув, можно также ударить об руку. Такими шокирующими действиями мы заставим скомковавшийся электролит разровняться.
А вот «печального» в этих батарейках будет несколько больше:
- они недостаточно долго сохраняются (три года и не больше);
- даже если батарейкой не пользоваться — она сама разрядится;
- электролит со временем склонен к высыханию;
- в условиях частых температурных перепадов батарейка очень неустойчиво работает;
- этот элемент питания имеет некоторые проблемы, связанные с герметичностью, отсюда возможны всевозможные протечки. Как правило, такое случается, если батарейку длительное время не используют — от этого корпус окисляется, что неминуемо принесёт ущерб аппаратуре, в которую она установлена;
- и главный минус — малая энергоёмкость.
Как работает батарейка
Сегодня в магазинах можно увидеть большое количество батареек, они различны по некоторым принципам, но схема работы у них одна. У любой батарейки есть положительный полюс (анод–цинк Zn), отрицательный полюс (катод–марганец Mg) и электролит (может быть сухим, жидким). Именно эти составляющие и являются основными элементами батарейки. Электрический ток бежит от анода (+) к катоду (—), но между ними обязательно должна быть нагрузка (лампочка, диод, двигатель или что-то ещё). Если нагрузки не будет (соединить «–» с «+» напрямую), то произойдёт короткое замыкание (К.З.). Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится. Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит. Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Как работает аккумуляторная батарейка, её отличие от обычной
Итак, мы рассмотрели классические «пальчиковые» и «мизинчиковые» элементы питания и знаем, что срок службы большинства из них строго ограничен (что бы там ни говорили именитые производители). Но как же быть с так называемыми АКБ – элементами питания аккумуляторного типа, способными не только расходовать энергию в процессе реакции, но и накапливать её и сохранять в течение долгого времени?
Для того чтобы понять принцип работы АКБ, необходимо обратиться к химии. В качестве примера возьмём… Обычный костёр на углях. Как бы красиво и завораживающе ни выглядело пламя, любой химик, наблюдая его, знает, что данный процесс представляет собой всего лишь длительную реакцию окисления топлива. Горящий уголь взаимодействует с кислородом и в качестве результата такой реакции мы получаем:
- углекислый газ;
- свет;
- тепло.
И если последние два пункта способны согреть душу и тело, то вот как-либо использовать углекислый газ мы не можем, ведь это побочный продукт реакции, являющийся, по сути, её отходом. Реакция окисления прекращается тогда, когда заканчиваются исходные элементы: кислород и уголь. Остановка реакции в батарейке происходит точно так же, когда исходные вещества полностью себя исчерпывают и остаются только «отходы».
В АКБ же всё происходит немного не так. Дело в том, что реакция, протекающая в ней, относится к разряду обратимых, то есть при определённых условиях её можно «повернуть вспять», вернув все вещества в их исходное состояние. Именно возможность протекания обратимой реакции в аккумуляторе позволяет заряжать его.
В АКБ, подключенной к сети, реакция протекает в обратном направлении, и ток идёт от «плюса» к «минусу», а не наоборот. Как результат – продукт реакции образует исходные вещества, а хозяин АКБ получает доступную «восстановленную» энергию в портативном формате. Вот и всё!
Ключевые преимущества
- Не подвержены влиянию высоких и низких температур. Неизменные эксплуатационные свойства в широком температурном диапазоне от −20°С до +60°С для батареи с BMS и вплоть до +150°С для блока элементов без BMS.
- Высокие показатели цикличности: расчётный ресурс службы — около 4500 циклов (>3000 циклов @ 80% DoD).
- Снижение ёмкости имеет прямолинейную нисходящую характеристику (то есть они не подвержены внезапному падению ёмкости как, например, свинцово-кислотные батареи).
- Очень высокие показатели удельной энергоёмкости (140 Вт·ч/кг и 280 Вт·ч/лит).
- Очень низкая совокупная стоимость владения в период эксплуатации и хранения.
- Длительный срок службы и практически неограниченный срок складского хранения: батареи не стареют и не утрачивают своих характеристик даже через 10-20 лет складского хранения.
- Батарея абсолютно герметичная: отсутствует газовыделение в окружающую среду.
- Изготавливаются без использования высокоядовитых материалов, таких как свинец, кадмий.
- На 100 % пригодны к утилизации: сталь, никель, железо, соль и керамика.
- На 70 % легче и на 30 % меньше свинцово-кислотных батарей.
Что такое солевые батарейки
Под солевыми батарейками понимаются элементы питания, относящиеся к «сухому» типу и содержащие соляной раствор в качестве электролита. Ещё не так давно данный тип батареек можно было назвать мировым лидером по соотношению качества и цены, однако со временем технологии шагнули вперёд и ситуация изменилась.
В составе классического солевого элемента питания можно найти три основных компонента: катод, анод и электролит. Первые два служат для образования тока между собой, а третий обеспечивает течение реакции, которая и приводит к возникновению напряжения. Катодом в таком элементе питания служит его оболочка, выполняемая из цинка, а в качестве анода используется диоксид марганца, тщательно пропитанный цинковым порошком.
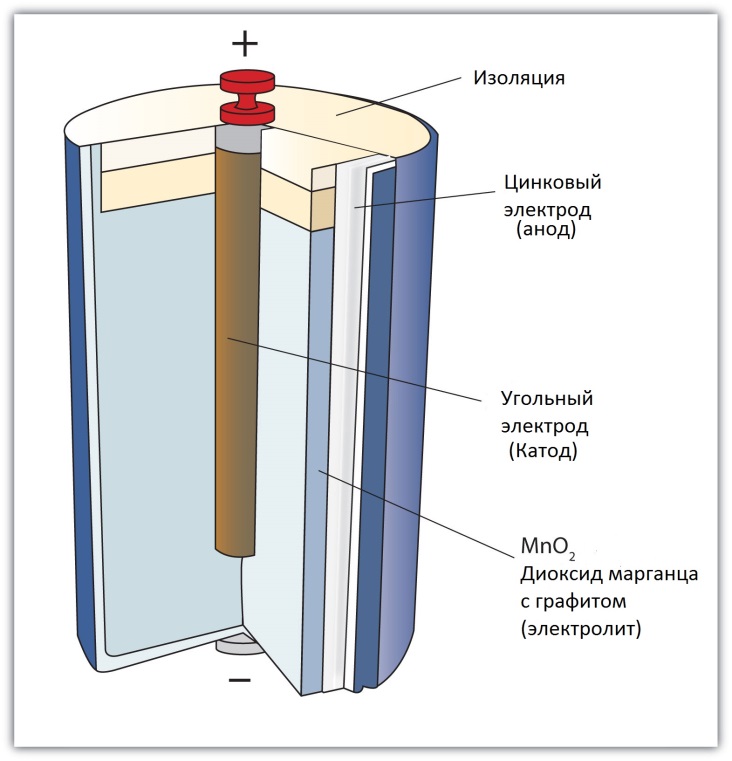
В прототипах современных батареек в качестве электролита использовалось небольшое количество загущенного крахмалом хлористого аммония (сейчас его можно встретить в составе некоторых пищевых продуктов под индексом Е510). На хлористый цинк его заменили несколько позже, а некоторые производители даже добавляли к цинку так называемую кальциевую соль.
Как мы уже отмечали, в процессе окислительно-восстановительной реакции, запускаемой при взаимодействии трёх компонентов, возникает электрический ток. Этот ток собирается при помощи токоснимателей устройства, затем направляется на электроды и только потом поступает на устройство-потребитель.
Небольшой вес и довольно низкая стоимость – вот два основных «козыря», которыми могут похвастать солевые элементы питания. К слову, если не «заставлять» их работать постоянно, а время от времени давать им «отлежаться», срок службы каждого отдельного элемента в значительной степени увеличится. Если речь идёт о приборе, который должен работать постоянно, можно приобрести два комплекта батареек и менять их по очереди через некоторое время.
Не лишены «солевые» и недостатков. К ним можно отнести небольшой срок хранения (до 3 лет), саморазряд, нестабильность работы в критических температурных условиях, иногда окисление оболочки и протекание. Кроме того, среднюю ёмкость около 0,8 А/ч нельзя назвать огромной. Впрочем, для ПДУ, небольшого фонарика или радиоприёмника этого чаще всего достаточно.