Принцип работы гальванического элемента
Содержание:
- Источник токов
- Об этой статье
- История изучения гальванических процессов
- История изучения гальванических процессов
- Общая информация
- Характеристики гальванических элементов
- Применение
- Разновидности гальванических элементов
- Разновидности гальванических элементов
- Виды электродов
- Принцип работы гальванического элемента
- Типы гальванических элементов
- Классификация гальванических элементов
- Устройство и принцип работы гальванического элемента
- Схема гальванического элемента
- Область использования
Источник токов
Существует два типа электрохимических элементов: гальванические и электролитические. Гальваническая клетка использует энергию, выделяемую во время спонтанной окислительно-восстановительной реакции для выработки электроэнергии.
Электролитическая ячейка потребляет энергию от внешнего источника, используя ее, чтобы вызвать непредвиденную окислительно-восстановительную реакцию.
Два типа ячеек
Гальванический элемент, история создания которого официально началась в 18 веке, дал старт развития науки электротехники. Во время проведения экспериментов с электричеством в 1749 году Бенджамин Франклин впервые ввел термин «батарея» для описания связанных конденсаторов. Однако его устройство не стала первой ячейкой. Находки археологов «батареи Багдада» в 1936 году имеют возраст более 2000 лет, хотя точное назначение их до сих пор спорно.
Луиджи Гальвани в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу».
Александро Вольт
В 1836 году Джон Фредерик Даниэль, исследуя способы преодоления проблем вольтовой кучи создал свою ячейку. За этим открытием последовало создание ячейки Уильяма Роберта Гроува в 1844 году. Первая аккумуляторная батарея была изготовлена из свинцово-кислотного элемента в 1859 году компанией Gaston Plante, далее появились гравитационная ячейка Калло в 1860 и ячейка Лекланш Жоржа Лекланша в 1866 году.
До этого момента все батареи были мокрого типа. В 1887 году Карл Гасснер создал первую сухую батарею, изготовленную из углеродно-цинковой батареи. Никель-кадмиевая батарея была представлена в 1899 году Вальдмаром Юнгнером вместе с никель-железной батареей. Однако Юнгнер не смог запатентовать ее и в 1903 году изобретатель Томас Эдисон запатентовал свой слегка измененный дизайн.
Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах.
Обратите внимание! Крупный прорыв в гальваническом направлении источников тока произошел в 1955 году, когда Льюис Урри, сотрудник компании «Energizer», представил общую щелочную батарею. 1970-е годы привели к никель-водородной батарее, а 1980-е годы к никель-металлогидридной батарее
Литиевые батареи были впервые созданы еще в 1912 году, однако наиболее успешный тип, литий-ионный полимерный аккумулятор, используемый сегодня в большинстве портативных электронных устройств, был выпущен только в 1996 году.
Об этой статье
wikiHow работает по принципу вики, а это значит, что многие наши статьи написаны несколькими авторами. При создании этой статьи над ее редактированием и улучшением работали, в том числе анонимно, 29 человек(а). Количество просмотров этой статьи: 21 652.
Категории: Дом и сад
English:Make a Homemade Battery
Español:hacer una batería casera
Português:Fazer Uma Pilha Caseira
Italiano:Costruire una Batteria fatta in Casa
Deutsch:Eine Batterie selber bauen
Français:fabriquer soi‐même une pile
Bahasa Indonesia:Membuat Baterai Rumahan
العربية:صنع بطارية منزلية الصنع
Nederlands:Zelf een batterij maken
한국어:집에서 건전지 만드는 방법
日本語:自家製電池を作る
Печать
История изучения гальванических процессов
Луиджи Гальвани
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом, профессором медицины Болонского университета (г. Болонья, Италия) — Луиджи Гальвани в году: Гальвани описал процесс сокращения мышц задних лапок свежепрепарированной лягушки, закреплённых на медных крючках, при прикосновении стального скальпеля. Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Итальянский физик и химик Алессандро Вольта, заинтересовавшись опытами Гальвани, увидел совершенно новое явление — создание потока электрических зарядов. Проверяя точку зрения Гальвани, А. Вольта проделал серию опытов и пришёл к выводу, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. В подтверждение — А. Вольта заменил лапку лягушки изобретённым им электрометром и повторил все действия.
В 1800 году А. Вольта впервые публично заявляет о своих открытиях на заседании Лондонского королевского общества, что проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления.
Русский учёный Петров в 1802 году использовал гальванический элемент для построения электрической дуги.
История изучения гальванических процессов
Луиджи Гальвани
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом, профессором медицины Болонского университета (г. Болонья, Италия) — Луиджи Гальвани в году: Гальвани описал процесс сокращения мышц задних лапок свежепрепарированной лягушки, закреплённых на медных крючках, при прикосновении стального скальпеля. Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Итальянский физик и химик Алессандро Вольта, заинтересовавшись опытами Гальвани, увидел совершенно новое явление — создание потока электрических зарядов. Проверяя точку зрения Гальвани, А. Вольта проделал серию опытов и пришёл к выводу, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. В подтверждение — А. Вольта заменил лапку лягушки изобретённым им электрометром и повторил все действия.
В 1800 году А. Вольта впервые публично заявляет о своих открытиях на заседании Лондонского королевского общества, что проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления.
В 1802 году русский физик Василий Владимирович Петров сконструировал самую большую в мире гальваническую батарею, состоявшую из 4200 медных и цинковых кружков диаметром около 35 миллиметров и толщиной около 2,5 миллиметра, между которыми были размещены бумажные, пропитанные раствором нашатыря. Именно Петровым впервые была применена изоляция (с помощью сургуча). Вся конструкция была помещена в ящик из твердой древесины красного дерева, покрытый изолирующим слоем из различных смол. По современным оценкам батарея Петрова давала напряжение около 1500В. Русский учёный исследовал свойства этой батареи как источника тока и показал, что действие её основано на химических процессах между металлами и электролитом. М. А. Шателен отмечал, что опыты Петрова можно считать исследованиями, положившими начало современной электрометаллургии в дуговых печах. Построенную им батарею Петров использовал для построения электрической дуги. Результаты его работы были подробно изложены в труде «Известия о гальвани-вольтовских опытах», увидевшем свет в 1803 году.
Общая информация
Гальванические элементы делятся на первичные и вторичные в соответствии со способностью вырабатывать электрический ток. Оба вида считаются источниками и служат для различных целей. Первые вырабатывают ток в ходе химической реакции, вторые функционируют исключительно после зарядки. Ниже обсудим обе разновидности. По количеству жидкостей различают две группы гальванических элементов:
-
Ярким примером приборов с единственной жидкостью считаются вольтов столб (1800 год) и элемент Волластона, которым пользовался первоначально Георг Ом в собственных исследованиях. Он состоял из медных пластин, свёрнутых в полые цилиндрической форму поверхности: первая вставлена во вторую. Обе ограждены от соприкосновения при помощи деревянных распорок. Электролитом служит разбавленная серная кислота. В результате происходит удвоение рабочих поверхностей. В ходе реакции образуется сульфат меди с выделением водорода, а цинк окисляется. В батарейках один электрод обычно угольный.
- В элементах с двумя жидкостями используется электролит с избытком кислорода для погружения электрода, где образуется водород. В результате происходит химическая реакция образования воды, нестабильность тока компенсируется и сглаживается. Первым идею использования источников выдвинул в 1829 году Беккерель. Первоначально для разделения ёмкостей использовался сосуд из слабо обожжённой глины, обладавший хорошей пористостью. Для компенсации выделения водорода на медном электроде допустимо использовать синий купорос.
Непостоянство источников питания с единственной жидкостью заметил Ом, открыв неприемлемость гальванического элемента Волластона для экспериментов по исследованию электричества. Динамика процесса такова, что в начальный момент времени ток велик и вначале растёт, потом за несколько часов падает до среднего значения. Современные аккумуляторы капризны.
Характеристики гальванических элементов
Гальванические элементы характеризуются электродвижущей силой (ЭДС), ёмкостью; энергией, которую он может отдать во внешнюю цепь; сохраняемостью.
- Электродвижущая сила (ЭДС) гальванического элемента зависит от материала электродов и состава электролита. ЭДС описывается термодинамическими функциями протекающих электрохимических процессов в виде уравнения Нернста.
- Электрическая ёмкость элемента — это количество электричества, которое источник тока отдаёт при разряде. Ёмкость зависит от массы реагентов, запасённых в источнике, и степени их превращения; снижается с понижением температуры или увеличением разрядного тока.
- Энергия гальванического элемента численно равна произведению его ёмкости на напряжение. С увеличением количества вещества реагентов в элементе и до определённого предела, с увеличением температуры, энергия возрастает. Энергию уменьшает увеличение разрядного тока.
- Сохраняемость — это срок хранения элемента, в течение которого его характеристики остаются в заданных пределах. Сохраняемость элемента уменьшается с ростом температуры хранения.
Применение
- Гальванические элементы используются в системе сигнализации, фонарях, часах, калькуляторах, аудиосистемах, игрушках, радио, автооборудовании, пультах дистанционного управления, компьютерах.
- Аккумуляторы используются для запуска двигателей машин; возможно так же и применение в качестве временных источников электроэнергии в местах, удалённых от населенных пунктов.
- Топливные элементы применяются в производстве электрической энергии (на электрических станциях), аварийных источниках энергии, автономном электроснабжении, транспорте, бортовом питании, мобильных устройствах.
Нередко, химические источники тока применяются в составе батарей (батареек).
Разновидности гальванических элементов
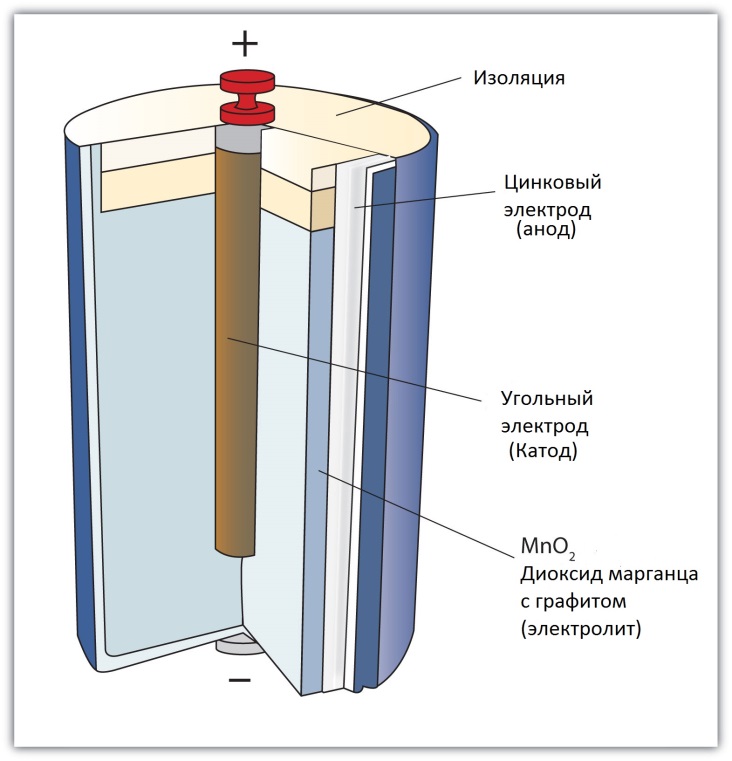
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Виды электродов
В состав гальванического элемента входят электроды.
Электроды бывают:
Обратимые электроды
- Электроды 1-го рода — электроды, состоящие из металла, погружённого в раствор его соли;
- Электроды 2-го рода — электрод, состоящий из металла, покрытого труднорастворимой солью этого же металла, погружённый в раствор соли, который содержит общий анион с нерастворимой солью (хлорсеребряный электрод, каломельный электрод, металл-оксидные электроды);
- Электроды 3-го рода — электроды, состоящие из двух нерастворимых осадков электролитов: в менее растворимом есть катион, который образуется из металла электрода, а в более растворимом — есть общий анион с первым осадком;
- Газовые электроды — электроды, состоящие из неактивного металла в растворе и газа (кислородный электрод, водородный электрод);
- Амальгамные электроды — электроды, состоящие из раствора металла в ртути;
- Окислительно-восстановительные электроды — электроды, состоящие из неактивного металла (ферри-ферро-электрод, хингидронный электрод).
Ионоселективные мембранные электроды
- Электроды с ионообменной мембраной с фиксированными зарядами — стеклянный электрод;
- Электроды, состоящие из жидких ассоциированных ионитов;
- Электроды с мембраной на основе мембраноактивных комплексонов;
- Электроды с моно- и поликристаллической мембранами.
Принцип работы гальванического элемента
Работа гальванического элемента осуществляется за счет движения электронов от одного металлического контакта к другому. Идет некое химическое превращение. Подробнее про термодинамику гальванического элемента и образование гальванического электричества читайте здесь.
Ответы на часто задаваемые вопросы
| Гальванический/ая | Разъяснение |
| Батарея | Источник энергии работающий за счет процессов, происходящих в ограниченном миниатюрном пространстве. В частности, энергия появляется, когда идет химическая реакция. |
| Элемент Вольта или Вольтов столб | Это энергетический элемент впервые созданный ученым по фамилии Вольт. |
| Процесс | Взаимодействие между химическими элементами в результате которого образуется электрический ток. |
| Разряд | Это завершение протекания химической реакции. То есть взаимодействия между веществами не будет.Гальванический разряд есть в игре Warframe. По сути это модификация, которая находится в большом дефиците. Ее используют для холодного оружия. Полярность V2. |
| Гальванический контакт | Это контакт между электродами и раствором. |
| Эффект | Появление разности между двумя контактами из 2-х типов металлов. Величина зависит от температуры и химии проводников. По сути это первый закон Вольта. |
| Соединение/связь/цепь | Объединение 2-х и более участков электрической цепи с источником тока. |
| Гальванический заряд | Наполнение батареи энергией. |
Гальваника – это протекание химических процессов с использование электрического тока. В ходе реакция сокращается количество растворенных катионов металла до такой степени что в конечном итоге они создают единое покрытие на металлическом электроде. В итоге предмет получается более прочным, исчезают небольшие вмятины и его вид становится более привлекательным.
Типы гальванических элементов
Выделяют ряд батареек определенных типов.
Таблица гальванических элементов
| Тип | Напряжение | Основные плюсы |
| Литиевые | 3 V | Большая емкость, высокая сила тока. |
| Солевые батарейки или угольно – цинковые | 1.5 в | Самые дешевые. |
| Никельоксигидроксильные NiOOH | 1.6 вольт | Повышенный ток. Большая емкость. |
| Щелочные или алкалиновые | 1.6 V | Большая сила тока. Хороший объем. |
Более детальнее эта тема раскрыта в статье виды батареек!
Назначение гальванического элемента
Он предназначен для запуска электрической технике. Это могут быть:
- Часы.
- Пульты.
- Фонарики.
- Медицинское оборудование.
- Ноутбуки.
- Игрушки.
- Брелки.
- Телефоны.
- Лазерные указки.
- Калькуляторы.
И им подобные окружающие нас вещи.
Классификация гальванических элементов
Использованные источники питания различных типов и размеров
Гальванические первичные элементы — это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля—Якоби.
Широкое распространение получили марганцево-цинковые элементы, не содержащие жидкого раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше: цинковый электрод служит катодом, электрод из смеси диоксида марганца с графитом служит анодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Литий-ионный аккумулятор сотового телефона
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую.
Одним из наиболее распространённых аккумуляторов является свинцовый (или кислотный). Электролитом является 25—30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решётки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в сульфат свинца (II) — PbSO4.
Также существуют щёлочные аккумуляторы: наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит гидроксид калия (K-OH).
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента, электроды не расходуются. Восстановителем является водород (H2), метанол (CH3OH), метан (CH4); в жидком или газообразном состоянии. Окислителем обычно является кислород — из воздуха или чистый.
В кислородно-водородном топливном элементе со щёлочным электролитом, происходит превращение химической энергии в электрическую.
Энергоустановки применяются на космических кораблях: они обеспечивают энергией космический корабль и космонавтов.
Устройство и принцип работы гальванического элемента
Металл, погруженный в раствор электролита, называется электродом.
Электроды — это система двух токопроводящих тел — проводников первого и второго рода.
К проводникам первого рода относятся металлы, сплавы, оксиды с металлической проводимостью, а также неметаллические материалы, в частности графит; носители заряда — электроны.
К проводникам второго рода относятся расплавы и растворы электролитов; носители заряда — ионы.
Устройство, состоящее из двух электродов, называется гальваническим элементом.
| Рис. 2. Схема медно-цинкового гальванического элемента |
Рассмотрим гальванический элемент Якоби—Даниэля (схема приведена на рис. 2). Он состоит из цинковой пластины, погруженной в раствор сульфата цинка, и медной пластины, погруженной в раствор сульфата меди. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
В гальваническом элементе электрод, сделанный из более активного металла, т.е. металла, расположенного левее в ряду напряжений, называют анодом, а электрод, сделанный из менее активного металла — катодом.
На поверхности цинкового электрода (анода) возникает двойной электрический слой и устанавливается равновесие:
Zn0 – 2ē ←→ Zn2+.
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медного электрода (катода) также возникает двойной электрический слой и устанавливается равновесие:
Cu2+ + 2ē ←→ Cu0.
В результате возникает электродный потенциал меди.
Так как потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, то при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, электроны будут переходить от цинка к меди. В результате этого процесса равновесие на цинковом электроде смещается вправо, поэтому в раствор перейдет дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдет разряд ионов меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы или не растворится весь цинк или не высадится на медном электроде вся медь.
Итак, при работе гальванического элемента Якоби—Даниэля протекают следующие процессы:
1. Анодный процесс, процесс окисления:
Zn0 – 2ē → Zn2+.
2. Катодный процесс, процесс восстановления:
Cu2+ + 2ē → Cu0.
3. Движение электронов во внешней цепи.
4. Движение ионов в растворе: анионов SO42– к аноду, катионов Cu2+ к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента.
Суммируя электродные реакции, получим:
Zn + Cu2+ = Zn2+ + Cu.
В результате протекании данной реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. Поэтому суммарную химическую реакцию, протекающую в гальваническом элементе, называют токообразующей реакцией.
Электрический ток в гальваническом элементе возникает за счет окислительно-восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделенными: на отрицательном электроде (аноде) происходит процесс окисления, на положительном электроде (катоде) — процесс восстановления.
Необходимым условием работы гальванического элемента является разность потенциалов электродов. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности между потенциалом катода и потенциалом анода элемента:
ЭДС = Eк – Ea . (1)
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определенный порядок в записи схемы элемента: записанный слева электрод должен быть отрицательным. Например, схема элемента Якоби—Даниэля записывается в виде:
Zn │ ZnSO4 ║ CuSO4 │ Cu .
Схема гальванического элемента
Устройство гальванического элемента
Самый простой энергетический накопитель состоит из:
- Стрежня из угля.
- Двух разнородных металлов.
- Электролита.
- Смола или пластик.
- Изолятора.
Как видно из этой схемы в составе строения гальванического элемента имеется отрицательный и положительный электрод. Они могут быть выполнены из меди, цинка и других металлов. Имеют название по типу медно цинковые. Иногда их называют сухие батарейки.
Обозначение гальванического элемента на схеме выполнено в виде двух вертикальных прямых приближенных друг к другу на небольшом расстоянии. Одна из которых будет меньше. По краям возле каждой такой линии имеются знаки, обозначающие полярность. У длинной линии ставят плюс, а у короткой минус. Рядом может располагаться вольтаж. Это означает что схема в которой используется батарейка работает только от этого напряжения.
Область использования
Электрохимия имеет множество важных применений, особенно в промышленности. Ее процессы используются для изготовления электрических батарей. Они имеют множество применений, включая:
- Топливный элемент преобразует химическую потенциальную энергию, получаемую при окислении топлива, например, газа, водорода, углеводородов, спиртов в электрическую энергию.
- Различные виды пьезозажигалок для газа.
- Электрические приборы, такие как мобильные телефоны.
- Цифровые камеры-литиевые.
- Слуховые аппараты (оксидно-серебряные).
- Электронные часы (ртутные/оксидно-серебряные).
- Военные источники тока (тепловые).
- Батарейки A, AA, AAA, D, C и другие.
Использование химических реакций для производства электричества в настоящее время является приоритетом для многих исследователей. Возможность адекватно использовать химические реакции в качестве источника энергии в значительной степени поможет решить проблемы загрязнения окружающей среды.