Альдегиды и кетоны
Содержание:
- Безопасность при обращении с муравьиной кислотой. Требования ГОСТа:
- Изомерия кетонов
- Физические свойства альдегидов и кетонов
- Химические свойства альдегидов и кетонов
- Суть взаимодействия
- Получение сахарозы из сахарной свеклы:
- Получение сахарозы из сахарного тростника:
- Разделение карбонильных соединений
- Применение муравьиной кислоты:
- Химические свойства муравьиной кислоты:
- Перспективные формулы Хеуорса
- Возможные проблемы
- Физические свойства муравьиной кислоты:
- Сахароза, формула, молекула, строение, вещество:
- Муравьиная кислота, формула, характеристики:
- Альдегиды: особенности строения
- Заключение
Безопасность при обращении с муравьиной кислотой. Требования ГОСТа:
Муравьиная кислота относится к веществам 2-го класса опасности (ГОСТ 12.1.007-76). Предельно допустимая концентрация ее в воздухе рабочей зоны производственных помещений (ПДК) составляет 1 мг/м3 (см. ГОСТ 5848-73 Реактивы. Кислота муравьиная. Технические условия (с Изменениями N 1, 2, 3)).
При превышении предельно допустимой концентрации пары муравьиной кислоты действуют раздражающе на слизистую оболочку верхних дыхательных путей и глаз; муравьиная кислота вызывает также ожог кожи.
Муравьиная кислота и ее растворы – легковоспламеняющиеся жидкости. Все работы с муравьиной кислотой следует проводить вдали от огня.
Все помещения, в которых проводятся работы с муравьиной кислотой, должны быть оборудованы общей приточно-вытяжной механической вентиляцией. Анализ муравьиной кислотой следует проводить в вытяжном шкафу лаборатории.
При работе с ней следует применять индивидуальные средства защиты. Не допускать попадания препарата внутрь организма. Первая помощь при ожогах – обильное промывание водой.
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета |
| Пентанон-2 | 3-Метилбутанон-2 |
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
| Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета |
| Пентанон-2 | Пентанон-3 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
| Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3 |
| Пропаналь | Ацетон (пропанон) |
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
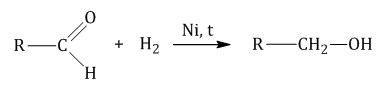
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
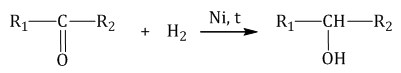
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
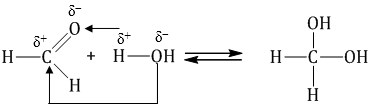
1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
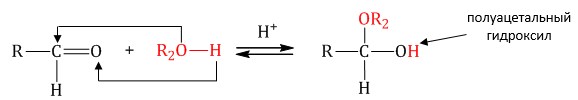
| Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами. |
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
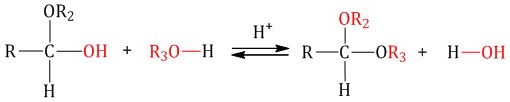
Суть взаимодействия
Качественная реакция на серебро подразумевает соблюдение определенного алгоритма действий. Часто даже при появлении признаков зеркального слоя его качество явно оставляет желать лучшего. В чем причины подобной неудачи? Можно ли избежать их? Среди множества проблем, которые могут привести к нежелательному результату, выделяют две основные:
- нарушение условий проведения химического взаимодействия;
- некачественная подготовка поверхности к серебрению.
В ходе взаимодействия исходных веществ в растворе образуются катионы серебра, объединяющиеся с альдегидной группой, образующие в итоге коллоидные мелкие частицы серебра. Эти крупники способны сцепляться со стеклом, но могут сохраняться в растворе в виде серебряной суспензии
Чтобы происходило сцепление частиц благородного металла со стеклом, формировался равномерный и прочный слой, важно провести предварительное обезжиривание стекла. Только при наличии идеально чистой исходной поверхности пробирки можно рассчитывать на образование равномерного серебряного слоя
Получение сахарозы из сахарной свеклы:
Сахарная свекла является двухлетним растением. В первый год собирают урожай корнеплодов и отправляют их на переработку.
На перерабатывающей фабрике корнеплоды промываются и измельчаются. Измельченные корнеплоды помещают в диффузоры (большие котлы) с горячей водой температурой 75 оС. Горячая вода вымывает из измельченных корнеплодов сахарозу и прочие компоненты. В итоге получается диффузионный сок, который в дальнейшем подвергается фильтрации от содержащихся в нем частичек мякоти.
На следующих стадиях производства сахара диффузионный сок очищают гидроксидом кальция и углекислым газом, уваривают, выпаривают на вакуумных аппаратах, подвергают дополнительной очистке, отбеливанию и центрифугированию. В итоге получают рафинированный сахар.
Получение сахарозы из сахарного тростника:
Сахарный тростник является основной мировой культурой для производства сахара. На его долю приходится до 65 % мирового производства сахара.
Сахарный тростник до начала цветения срезают. Срезанные стебли измельчают и размалывают. Из полученной массы отжимают сок, в котором содержится до 0,03 % белковых веществ, 0,1 % зернистых веществ (крахмала), 0,22 % азотосодержащей слизи, 0,29 % солей (большей частью органических кислот), 18,36 % сахара, 81 % воды и очень небольшое количество ароматических веществ, придающих сырому соку своеобразный запах.
Для очистки сока к нему добавляют свежегашеную известь – Са(ОН)2 и нагревают. Сахароза вступает в химическую реакцию с гидроксидом кальция, в результате чего образуется растворимый в воде сахарат кальция. Кроме того, другие вещества, содержащиеся в соке, также вступают в реакцию с гидроксидом кальция, образуя малорастворимые и нерастворимые соли, которые выпадают в осадок и отфильтровывают.
Затем через раствор, чтобы разложить сахарат кальция и нейтрализовать избыточный гидроксид кальция, пропускают углекислый газ – СО2. В итоге образуется карбонат кальция – СаСО3, который выпадает в осадок. Выпавший в осадок карбонат кальция отфильтровывают, а раствор выпаривают в вакуумных аппаратах до получения кристаллов сахарозы. На данной стадии производства сахароза все еще содержит примеси – мелассу и имеет коричневый цвет. Меласса придает сахарозе ярко выраженный естественный аромат и вкус. Полученный продукт именуется коричневым сахаром или тростниковым нерафинированным сахаром. Он (коричневый сахар) пригоден в пищу. Его можно использовать в пищу как есть либо подвергнуть дополнительной очистке.
На последней стадии производства сахарозу подвергают дополнительной очистке и обесцвечиванию. В конечном итоге получают рафинированный (очищенный) сахар, имеющий белый цвет.
Разделение карбонильных соединений
Для образования комплексного соединения оксид серебра растворяют в нашатырном спирте. Учитывая, что процесс является обратимой реакцией, реакция серебряного зеркала выполняется со свежеприготовленным аммиачным раствором оксида серебра (1). При смешивании комплексного соединения аргентума с альдегидом происходит окислительно-восстановительная реакция. О завершении процесса свидетельствует выпадение в осадок металлического серебра. При правильном осуществлении взаимодействия этаналя и аммиачного раствора оксида серебра на стенках пробирки наблюдается образование серебряного налета. Именно визуальный эффект дал подобному взаимодействию название «серебряного зеркала».

Применение муравьиной кислоты:
Муравьиная кислота применяется:
– в медицине,
– в сельском хозяйстве, как консервант сена и силоса,
– в химической промышленности в качестве растворителя,
– в пищевой промышленности в качестве консерванта,
– в текстильной промышленности для окрашивания шерсти,
– в пчеловодстве как средство для борьбы с паразитами.
Примечание: Фото //www.pexels.com, //pixabay.com
Как возможно научиться писать тексты и зарабатывать на этом удаленно? Например, можете пройти курс «Копирайтинг от А до Я», который подойдет даже начинающим авторам.
Другие записи:
карта сайта
Коэффициент востребованности
5 969
Химические свойства муравьиной кислоты:
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные.
Для нее характерны следующие химические реакции:
- 1. реакция муравьиной кислоты с щелочами:
HCOOH + NaOH → HCOONa + H2O,
HCOOH + KOH → HCOOK + H2O.
В ходе данной реакции образуется формиат натрия (формиат калия) и вода.
- 2. реакция муравьиной кислоты с гидроксидами:
HCOOH + 2Cu(OH)2 → CO2 + Cu2O + 3H2O.
В ходе данной реакции образуется углекислый газ, оксид меди и вода.
- 3. реакция разложения муравьиной кислоты при нагревании:
HCOOH → CO + H2O (to, kat = H2SO4 (конц.) или P4O10).
При нагревании с сильными водоотнимающими средствами, такими как концентрированная серная кислота или оксид фосфора, разлагается на моноксид углерода (угарный газ) и воду.
- 4. реакция образования сложных эфиров:
Муравьиная кислота, вступая в реакцию со спиртами, образует сложные эфиры.
HCOOH + СН3ОН→ HCOOCH3 + H2O.
В результате химической реакции муравьиной кислоты с метанолом (метиловым спиртом) образуется метилформиат (метиловый эфир муравьиной кислоты) и вода.
- 5. реакция с аммиачным раствором оксида серебра (реакция серебряного зеркала):
HCOOH + 2[AgNH3)2]ОН→ 2Ag + (NH4)2CO3 + 2NH3 + H2O.
Поскольку муравьиная кислота проявляет свойства альдегидов, то для нее характерна реакция «серебряного зеркала». Реакция «серебряного зеркала» является качественной реакцией на альдегиды. В результате реакции образуется металлическое серебро. Если реакция проводится в сосуде с чистыми и гладкими стенками, то серебро осаждается на них в виде тонкой плёнки, образуя зеркальную поверхность. При наличии малейших загрязнений серебро выделяется в виде серого рыхлого осадка.
Перспективные формулы Хеуорса
Вновь образованная гидроксильная группа (ОН) называется гликозидной.
По своим свойствам она значительно отличается от спиртовых (гликозных)гидроксильных групп моносахаридов.
Атом кислорода из гидроксильной группы пятого атома углерода соединяется с углеродом альдегидной группы, в результате чего образуется кольцо:
Альфа- и бета-аномеры глюкозы различаются положением гликозидной группы ОНотносительно углеродной цепи молекулы.
Мы рассмотрели возникновение шестичленного цикла.
Но циклы, также могут бытьпятичленными.
Это произойдёт в том случае, если углерод из альдегидной группы соединиться с кислородом гидроксильной группы при четвёртом атоме углерода, а не при пятом, как рассматривалось выше. Получится кольцо меньшего размера.
Шетичленные циклы называются пиранозными, пятичленные – фуранозными.
Названия циклов происходят от названий родственных гетероциклических соединений –фурана и пирана.
В названиях циклических форм наряду с названием самого моносахарида указывается «окончание» – пираноза или фураноза, характеризующие размер цикла.
Например: альфа-D-глюкофураноза, бета-D-глюкопираноза и т.д.
Циклические формы моносахаридов термодинамически более устойчивы в сравнении с открытыми формами, поэтому в природе они получили большее распространение.
Глюкоза
Глюкоза (от др.-греч.
γλυκύς — сладкий) (C6H12O6) или виноградный сахар –важнейший из моносахаридов; белые кристаллы сладкого вкуса, легко растворяется в воде.
Глюкозное звено входит в состав ряда дисахаридов (мальтозы, сахарозы и лактозы) иполисахаридов (целлюлоза, крахмал).
Глюкоза содержится в соке винограда, во многих фруктах, а также в крови животных и человека.
Мышечная работа совершается, главным образом, за счёт энергии, выделяющейся при окислении глюкозы.
Глюкоза является шестиатомным альдегидоспиртом:
Глюкоза получается при гидролизе полисахаридов (крахмала и целюлозы) под действием ферментов и минеральных кислот.
В природе глюкоза образуется растениями в процессе фотосинтеза.
Фруктоза
Фруктоза или плодовый сахар С6Н12О6 – моносахарид, спутник глюкозы во многих плодовых и ягодных соках.
Фруктроза в качестве моносахаридного звена входит в состав сахарозы и лактулозы.
Фруктоза значительно слаще глюкозы.
Смеси с ней входят в состав мёда.
По строению фруктоза представляет собой шестиатомный кетоноспирт:
В отличие от глюкозы и других альдоз, фруктоза неустойчива как в щелочных, так и кислых растворах; разлагается в условиях кислотного гидролиза полисахаридов или гликозидов.
Галактоза
Галактоза — моносахарид, один из наиболее часто встречающихся в природе шестиатомных спиртов — гексоз.
Галактоза cуществует в ациклической и циклической формах.
Отличается от глюкозы пространственным расположением групп у 4-го атома углерода.
Галактоза хорошо растворима в воде, плохо в спирте.
В тканях растений галактоза входит в состав рафинозы, мелибиозы, стахиозы, а также в полисахариды — галактаны, пектиновые вещества, сапонины, различные камеди и слизи, гуммиарабик и др.
В организме животных и человека галактоза — составная часть лактозы (молочного сахара), галактогена, группоспецифических полисахаридов, цереброзидов и мукопротеидов.
Галактоза входит во многие бактериальные полисахариды и может сбраживаться так называемыми лактозными дрожжами.
В животных и растительных тканях галактозалегко превращается в глюкозу, которая лучше усваивается, может превращаться в аскорбиновую и галактуроновую кислоты.
Олигосахариды. Сахароза.
Олигосахариды – это один из видов полисахаридов.
Олигосахариды представляют собой углеводы, состоящие из нескольких моносахаридных остатков (от греч.
ὀλίγος — немногий).
Как правило, их молекулы содержат от 2 до 10 моносахаридных остатков и имеют относительно небольшую молекулярную массу.
Наиболее распространёнными из олигосахаридов являются дисахариды итрисахариды.
Дисахариды
Молекулы дисахаридов состоят из двух остатков моносахаридов.
Общая формула дисахаридов, как правило, C12H22O11.
| Мальтоза + Н2О = D-глюкоза + D-глюкоза |
| Целлобиоза + Н2О = D-глюкоза + D-глюкоза |
| Лактоза + Н2О = D-глюкоза + D-галактоза |
| Сахароза + Н2О = D-глюкоза + D-фруктоза |
Дата добавления: 2016-12-03; просмотров: 413 | Нарушение авторских прав
Похожая информация:
Поиск на сайте:
Возможные проблемы
В качестве основного загрязнителя стеклянной посуды выступает жирный налет, от которого необходимо избавляться. Проблему поможет решить раствор щелочи, а также горячая хромовая смесь. Далее пробирка промывается дистиллированной водой. При отсутствии щелочи можно воспользоваться синтетическим средством для мытья посуды. После завершения обезжиривания стекло промывают раствором хлорида олова, ополаскивают водой. Для приготовления растворов используют дистиллированную воду. В случае ее отсутствия можно воспользоваться дождевой водой. В качестве восстановителей, позволяющих из раствора осаждать чистое вещество, применяют глюкозу и формальдегид. С альдегидом трудно рассчитывать на получение качественного серебряного покрытия, а вот моносахарид (глюкоза) дает равномерный и прочный серебряный слой на поверхности зеркала.

Физические свойства муравьиной кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | резкий запах |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), г/см3 | 1,2196 |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), кг/м3 | 1219,6 |
| Температура плавления, °C | 8,25 |
| Температура кипения, °C | 100,7 |
| Тройная точка, °C | 8,25 при 2,2 кПа |
| Критическая точка, °C | 315 при 5,81 МПа |
| Температура вспышки, °C | 60 |
| Температура самовоспламенения, °C | 504 |
| Константа диссоциации | 1,772⋅10-4 |
| Константа диссоциации кислоты | 3,75 |
| Взрывоопасные концентрации смеси с воздухом, % объёмных | от 18 до 57 |
| Удельная теплота сгорания, МДж/кг | 4,58 |
| Молярная масса, г/моль | 46,03 |
Сахароза, формула, молекула, строение, вещество:
Сахароза – дисахарид из группы олигосахаридов, состоящий из двух моносахаридов: α-глюкозы и β-фруктозы, имеющий формулу C12H22O11.
В быту сахароза именуется сахаром, тростниковым сахаром или свекловичным сахаром.
Олигосахариды – это углеводы, содержащие от 2 до 10 моносахаридных остатков. Дисахариды – углеводы, которые при нагревании с водой в присутствии минеральных кислот или под влиянием ферментов подвергаются гидролизу, расщепляясь на две молекулы моносахаридов.
Сахароза является весьма распространённым в природе дисахаридом. Она встречается во многих фруктах, плодах, ягодах, в стеблях и листьях растений, в соке деревьев. Особенно велико содержание сахарозы в сахарной свёкле, сахарном тростнике, сорго, сахарном клене, кокосовой пальме, финиковой пальме, аренге и иных пальмах, которые используются для промышленного производства пищевого сахара.
Химическая формула сахарозы C12H22O11.
Аналогичную общую химическую формулу имеют и другие дисахариды: лактоза, состоящая из остатков глюкозы и галактозы, и мальтоза, состоящая из остатков глюкозы.
Строение молекулы сахарозы, структурная формула сахарозы:
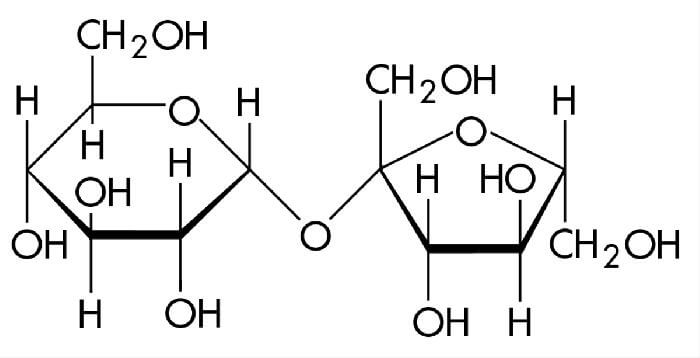
Молекула сахарозы образована из двух остатков моносахаридов – α-глюкозы и β-фруктозы, соединённых между собой атомом кислорода и связанных друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных гидроксилов) – (1→2)-гликозидной связью.
Систематическое химическое наименование сахарозы: (2R,3R,4S,5S,6R)-2-окси-6-(гидроксиметил)оксан-3,4,5-триол.
Используется также и другое химическое название сахарозы: α-D-глюкопиранозил-β-D-фруктофуранозид.
Сахароза по внешнему виду сахароза представляет собой белое кристаллическое вещество. На вкус более сладкая, чем глюкоза.
Сахароза очень хорошо растворяется в воде. Малорастворима в этаноле и метаноле. Не растворима в диэтиловом эфире.
Сахароза, попадая в кишечник, под действием ферментов быстро гидролизуется на глюкозу и фруктозу, после чего всасывается и попадает в кровь.
Температура плавления сахарозы 160 °C. Расплавленная сахароза застывает, образуя аморфную прозрачную массу – карамель.
Если расплавленную сахарозу продолжить нагревать, то при температуре 186 °C сахароза разлагается с изменением окраски – с прозрачной на коричневую.
Сахароза служит источником глюкозы и важнейшим источником углеводов для организма человека.
Муравьиная кислота, формула, характеристики:
Муравьиная кислота (также – метановая кислота) – органическое вещество, относящееся к насыщенным одноосновным карбоновым кислотам.
Химическая формула муравьиной кислоты CH₂O₂. Рациональная формула муравьиной кислоты HCOOH. Изомеров не имеет.
Строение молекулы муравьиной кислоты:
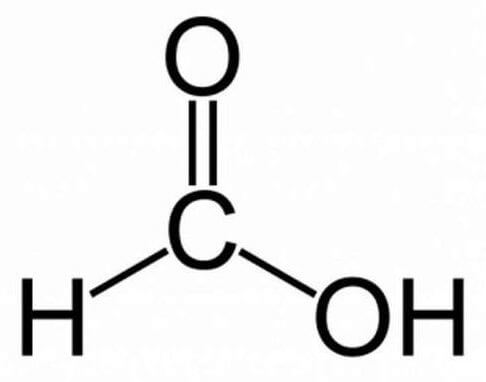
Муравьиная кислота (метановая кислота) – простейшая карбоновая кислота, родоначальник класса карбоновых кислот.
Муравьиная кислота – бесцветная жидкость, обладающая резко пахнущим запахом.
Муравьиная кислота – легковоспламеняющаяся жидкость с температурой вспышки 60 °С, температурой самовоспламенения 504 °С.
Водный раствор, содержащий 85% муравьиной кислоты, также является горючей жидкостью с температурой вспышки (в открытом тигле) 71 °С, температурой воспламенения 83 °С.
При температуре выше 69°C муравьиная кислота может образовывать взрывоопасныe смеси пар/воздух.
Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
В качестве пищевой добавки муравьиная кислота зарегистрирована как E236.
Муравьиная кислота своё название получила из-за того, что была впервые выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв.
В природе муравьиная кислота содержится в яде пчел, в крапиве, хвое, выделениях медуз, фруктах (яблоках, малине, клубнике, авокадо и пр.).
Соли и анионы муравьиной кислоты называются формиатами.
Название муравьиной кислоты на английском – formic acid.
Муравьиная кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Альдегиды: особенности строения
Представители данного класса являются производными предельных углеводородов, в которых радикал соединен с альдегидной группой. Изомерами альдегидов являются кетоны. Сходство их состоит в принадлежности к классу карбонильных соединений. При выполнении задания, предполагающего в смеси выделить альдегид, потребуется реакция «серебряного зеркала». Проанализируем особенности данного химического превращения, а также условия его осуществления. Реакция серебряного зеркала представляет собой процесс восстановления из гидроксида диамин серебра (1) металлического серебра. В упрощенном виде допускается запись данного комплексного соединения в упрощенном виде оксида серебра (1).
Заключение
Чтобы посеребрить стекло, желательно использовать нитрат серебра. К раствору этой соли добавляют щелочь и раствор аммиака. Условием проведения полноценной реакции и осаждения на стекле серебра является создание щелочной среды. Но при переизбытке данного реагента возможны побочные эффекты. В зависимости от выбранной методики проведения эксперимента получение качественной реакции осуществляется при нагревании. Окрашивание раствора в коричневый цвет свидетельствует об образовании мельчайших коллоидных частичек серебра. Далее на поверхности стекла появляется зеркальный налет. В случае успешного прохождения процесса слой металла будет ровным и прочным.