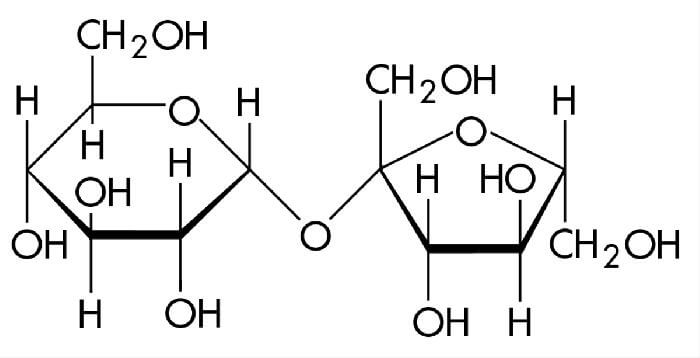
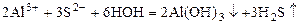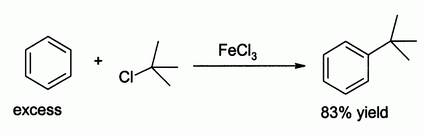Углеводы
Содержание:
- Состав и строение жиров
- Примечания
- Взаимодействие с концентрированной серной кислотой
- Моносахариды
- Глюкоза
- Радикально-функциональная номенклатура
- Применение
- Производство
- Структура
- Рациональная номенклатура
- История
- Тривиальная номенклатура
- Химические свойства глюкозы
- Реакции замещения
- Безопасность
- Крахмал
- Связанные материалы
- Свойства алкинов
- Применение отдельных представителей
Состав и строение жиров
Состав и строение жиров
Жиры – это сложные эфиры глицерина и высших жирных карбоновых кислот. Общая формула жиров выглядит следующим образом:
Твердые жиры образованы преимущественно высшими предельными карбоновыми кислотами – стеариновой С17Н35СООН, пальмитиновой С15Н31СООН и некоторыми другими.
Жидкие жиры образованы высшими непредельными карбоновыми кислотами – олеиновой С17Н35СООН, линолевой С17Н31СООН и линоленовой С17Н29СООН. Названия жиров образуются прибавлением окончания —ат. Например, тристеарат, трипальмиат.
В зависимости от происхождения жиры делят на животные и растительные (см. Рис. 1).
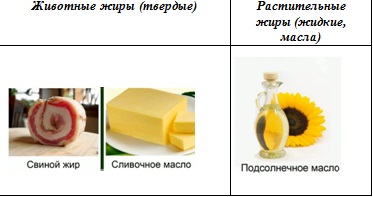
Рис. 1. Животные и растительные жиры
Жиры животного происхождения твердые. Исключением является рыбий жир. Жиры растительного происхождения жидкие. Их называют маслами. Исключением является кокосовое масло.
Примечания
- ↑ Introduction to Chemical Engineering Thermodynamics (англ.) // J. Chem. Educ.
- ↑
- ↑
- Helmut Fiege, P.J. Garratt, Christ. J. Grundmann, Gundermann, Wolfgang Loeser, Peter Müller, Heidi Müller-Dolezal, Peter L. Pauson, Renate Stoltz, Hanna Söll, M. Zander Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition: Arenes and Arynes, Издание четвёртое, Georg Thieme Verlag, 2014, ISBN 3131799749, 9783131799746
- Kasper, Dennis L.et al. (2004) Harrison’s Principles of Internal Medicine, 16th ed., McGraw-Hill Professional, p. 618, ISBN 0071402357.
- Розенцвит Г. Э. Клиника профессиональных нейротоксикозов. Л,, 1964, 18 с.
- Кушелев В. П., Орлов Г. Г., Сорокин Ю. Г. Охрана труда в нефтеперерабатывающей и нефтехимической промышленности. — М.: Химия, 1983. — С. 42. — 472 с.
Взаимодействие с концентрированной серной кислотой
Концентрированная серная кислота отнимает воду от углеводов, при этом образуется углерод С («обугливание») и вода.
| Например, при действии концентрированной серной кислоты на глюкозу образуются углерод и вода |
C6H12O6 → 6C + 6H2O
Моносахариды
| Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (группа альдегида или кетона) и несколько гидроксильных. |
Моносахариды являются структурными звеньями олигосахаридов и полисахаридов.
Важнейшие моносахариды
| Название и формула |
Глюкоза
C6H12O6 |
Фруктоза
C6H12O6 |
Рибоза
C6H12O6 |
| Структурная формула | |||
| Классификация |
|
|
|
Глюкоза
Глюкоза – это альдегидоспирт (альдоза).
Она содержит шесть атомов углерода, одну альдегидную и пять гидроксогрупп.
Глюкоза существует в растворах не только в виде линейной, но и циклических формах (альфа и бета), которые являются пиранозными (содержат шесть звеньев):
| α-глюкоза | β-глюкоза |
Радикально-функциональная номенклатура
- применяется для названия простых моно- и бифункциональных соединений
- подчеркивает главную химическую особенность соединений
Правила построения названия по радикально-функциональной номенклатуре:
- выбирают старшую характеристическую группу (обозначается названием функционального класса), затем добавляют название органического радикала
- название функционального класса определяется старшей характеристической группой, другие группы обозначаются приставками
- в соединениях с многовалентными характеристическими группами различные радикалы перечисляются в алфавитном порядке
- одинаковые радикалы обозначаются умножающими приставками (ди-, три-)
Примеры названий соединений по радикально-функциональной номенклатуре
изобутиловый спирт
Винилхлорид
Этилцианид
Пропионилхлорид
бензилэтилкетон
метилдиэтиламин
изопропилметилсульфид
Изобутилэтиловый эфир
Диметилсульфоксид
Втор.бутилхлорид
2-Бромбутиловый спирт
3-Гидроксиизопропилкетон
Применение
Перевозка бензола железнодорожным транспортом осуществляется в специализированных вагонах-цистернах
Значительную часть получаемого бензола используют для синтеза других продуктов:
- около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом);
- около 25 % бензола превращают в кумол (алкилирование бензола пропиленом);
- приблизительно 10—15 % бензола гидрируют в циклогексан;
- около 10 % бензола расходуют на производство нитробензола;
- 2—3 % бензола превращают в линейные алкилбензолы;
- приблизительно 1 % бензола используется для синтеза хлорбензола.
В существенно меньших количествах бензол используют для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя.
Кроме того, бензол входит в состав бензина. В 1920-х — 1930-х годах, бензол добавляли<span title=»Статья «Бензино-бензоловые топлива» в русском разделе отсутствует»>ru</span>de в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. Ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %.
Производство
На сегодняшний день существует несколько принципиально различных способов производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
-
Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- Пиролиз бензиновых и более тяжелых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
-
Получение бензола методом Реппе
Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло, работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции. Полностью механизм реакции был описан только в 2020 году сотрудниками Института органической химии им. Н. Д. Зелинского РАН.
Структура
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n−6), но в отличие от углеводородов ряда этилена, C2H4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
В специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. Бензольное кольцо входит в состав множества различных соединений.
Рациональная номенклатура
За основу рационального названия органического соединения берется название прототипа, атомы водорода которого замещены радикалами. В качестве прототипа выступает, как правило, простейший член гомологического ряда.
| Класс | Прототип | Правило | Пример |
| Алканы | Метан |
за метановый углерод выбирают наиболее разветвленный атом углерода примыкающие радикалы должны быть наименее сложными наличие нескольких одинаковых радикалов обозначается соответствующей умножающей приставкой «ди-«, «три-«, «тетра-« |
Метилэтилизопропилметан |
| Непредельные углеводороды | Этилен, ацетилен | Для указания местоположения заместителей С-атомы прототипа обозначают греческими буквами α и β или цифрами 1 и 2. |
α-этил-β-третбутилэтилен |
| Спирты | Карбинол |
Изопропенилтретбутилкарбинол |
|
| Альдегиды | Уксусный альдегид |
Винилизопропилуксусный альдегид |
|
| Кетоны | Кетон |
Метилпропаргилкетон |
|
| Карбоновые кислоты | Уксусная кислота |
Изопропилэтинилуксусная кислота |
История
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной в 1651 году. Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. Вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физико-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К 1860-м годам было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — CnHn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось в то время наиболее полно описать свойства бензола.
Тривиальная номенклатура
На начальном этапе развития химии природа органических веществ не была полностью понятна, поэтому им давались тривиальные названия, связанные с их свойствами (глицин – сладкий) или источниками их получения (винный спирт). Устоявшиеся тривиальные названия допускаются к употреблению правилами ИЮПАК.
Тривиальные названия носят простейшие предельные углеводороды, и они лежат в основе названий всех других классов ациклических соединений, а названия радикалов применяются в номенклатурах ИЮПАК и рациональной номенклатуре.
Названия н-алканов СnH2n+2
| Формула алкана | Название |
| CH4 | Метан |
| C2H6 | Этан |
| C3H8 | Пропан |
| C4H10 | Бутан |
| C5H12 | Пентан |
| C6H14 | Гексан |
| С7Н16 | Гептан |
| С8Н18 | Октан |
| C9H20 | Нонан |
| С10H22 | Декан |
| С11Н24 | Ундекан |
| С12Н26 | Додекан |
| С13H28 | Тридекан |
| C14-C19 | Тетрадекан и т. д. |
| С20Н42 | Эйкозан |
| C21H44 | Генэйкозан |
| С22Н46 | Докозан |
| С23Н48 | Трикозан |
| С24-C29 | Тетракозан и т.д. |
| С30Н62 | Триаконтан |
| C31H64 | Гентриаконтан |
| С32-C39 | Дотриаконтан и т.д. |
| С40Н82 | Тетраконтан |
| С41Н84 | Гентетраконтан и т.д. |
Названия некоторых одновалентных радикалов
| Формула алкана и его название | Формула алкила | Название алкила | |
| тривиальное | систематическое | ||
|
Пропан |
Пропил | Пропил | |
| Изопропил | 1-метилэтил | ||
|
Бутан |
Бутил | Бутил | |
| Втор. бутил | 1-метилпропил | ||
|
Изобутил |
Изобутил | 2-метилпропил | |
| Трет. бутил | 1,1-диметилэтил | ||
|
Изопентан |
Изопентил | 3-метилбутил | |
| Втор. Изопентил | 1,2-диметилпропил | ||
| Трет. пентил | 1,1-диметилпропил | ||
| — | 2-метилбутил | ||
|
Неопентан |
Неопентил | 2,2-диметилпропил |
Названия некоторых непредельных радикалов
| Формула радикала | Название радикала | |
| Тривиальное | Систематическое | |
| H2C=CH– | Винил | Этенил |
| HC≡C– | — | Этинил |
| H2C=CH–CH2– | Аллил | Пропен-2-ил |
| HC≡C–CH2– | Пропаргил | Пропин-2-ил |
| H3C–CH=CH– | Пропенил | Пропен-1-ил |
| H2C=C–CH3 | |
Изопропенил | 1-метилэтенил |
Химические свойства глюкозы
Водный раствор глюкозы
В водном растворе глюкозы существует динамическое равновесие между двумя циклическими формами — α и β и линейной формой:
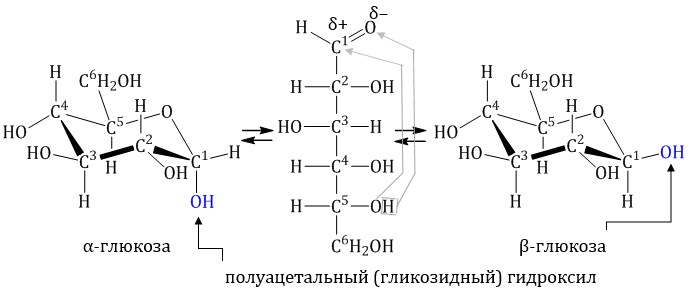
Реакции на карбонильную группу — CH=O
Глюкоза проявляет свойства, характерные для альдегидов.
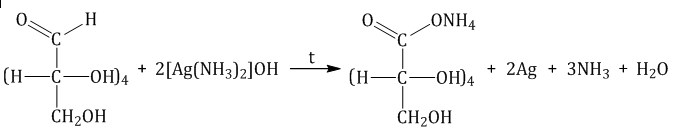
Реакция «серебряного зеркала»
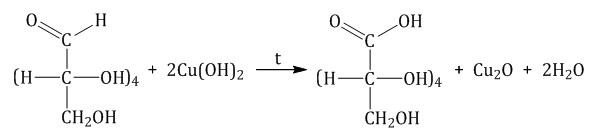
Реакция с гидроксидом меди (II) при нагревании. При взаимодействии глюкозы с гидроксидом меди (II) выпадает красно-кирпичный осадок оксида меди (I):
Окисление бромной водой. При окислении глюкозы бромной водой образуется глюконовая кислота:
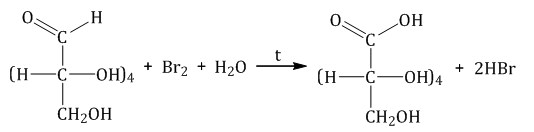
Также глюкозу можно окислить хлором, бертолетовой солью, азотной кислотой.
| Концентрированная азотная кислота окисляет не только альдегидную группу, но и гидроксогруппу на другом конце углеродной цепи. |
Каталитическое гидрирование. При взаимодействии глюкозы с водородом происходит восстановление карбонильной группы до спиртового гидроксила, образуется шестиатомный спирт – сорбит:
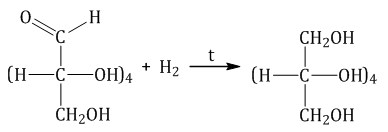
Брожение глюкозы. Брожение — это биохимический процесс, основанный на окислительно-восстановительных превращениях органических соединений в анаэробных условиях.
Спиртовое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
C6H12O6 → 2C2H5OH + 2CO2
Молочнокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
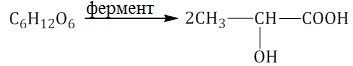
Маслянокислое брожение. При спиртовом брожении глюкозы образуются спирт и углекислый газ:
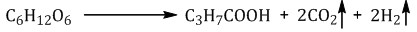
Образование эфиров глюкозы (характерно для циклической формы глюкозы).
Глюкоза способна образовывать простые и сложные эфиры.
Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила.
Например, α-D-глюкоза взаимодействует с метанолом.
При этом образуется монометиловый эфир глюкозы (α-O-метил-D-глюкозид):
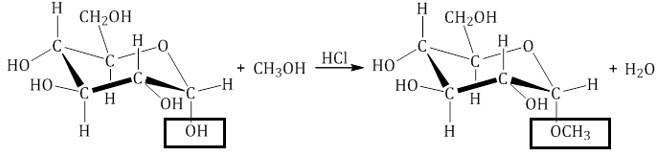
| Простые эфиры глюкозы получили название гликозидов. |
В более жестких условиях (например, с CH3-I) возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами.
| Например, β-D-глюкоза реагирует с уксусным ангидридом в соотношении 1:5 с образованием пентаацетата глюкозы (β-пентаацетил-D-глюкозы): |
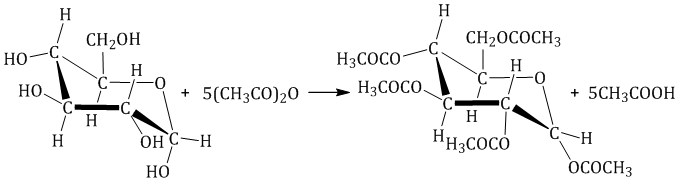
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Безопасность
Работа с применением бензола сопряжена с риском отравления и серьёзного ухудшения здоровья. Бензол — легколетучая жидкость (летучесть 320 мг/л при 20 °С) с высокой степенью воспламенения, поэтому при работе с ним необходимо соблюдать технику безопасности работ с легковоспламеняющимися жидкостями. Большую опасность представляют пары бензола, так как они могут образовывать взрывоопасные смеси с воздухом. В настоящее время применение бензола в качестве органического растворителя сильно ограничено, ввиду токсичности и канцерогенного воздействия его паров и негативном воздействии на кожу. Работа с бензолом в лабораториях также предусматривает его ограничение (строго регламентирована). Бензол рекомендуется использовать в экспериментах лишь в небольших объёмах (не более 50 мл), работа должна проводиться исключительно в перчатках из фторкаучука (латекс растворяется и набухает при воздействии на него бензолом).
Категорически запрещается:
- хранить вблизи источников тепла, открытого огня, сильных окислителей, пищевых продуктов, и так далее,
- оставлять в открытом виде тару, содержащую бензол, курить,
- использовать тару из-под бензола для пищевого применения, мытья рук, посуды,
- производить работу в закрытом, плохо вентилируемом помещении с температурой воздуха больше 30°С,
- использовать большой объём вещества в качестве растворителя,
- работать без средств защиты кожи рук, глаз и органов дыхания.
ПДК в воздухе составляет 5 мг/м3 (среднесменная за 8 часов).
Охрана труда
В России ПДК бензола в воздухе рабочей зоны установлена равной 5 мг/м3 (среднесменная за 8 часов) и 15 мг/м3 (максимально-разовая). Однако по данным ряда исследований, порог восприятия запаха этого вещества может быть гораздо выше ПДКрз. Например, среднее значение порога в исследовании было в ~ 100 раз выше среднесменной ПДКрз, и в ~ 30 раз выше максимально-разовой ПДКрз. А у части людей порог был значительно выше среднего значения. Поэтому можно ожидать, что использование широко распространённых в сочетании с «заменой по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию паров бензола на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от бензола следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Крахмал
Крахмалом называется полисахарид, построенный из остатков циклической α-глюкозы.
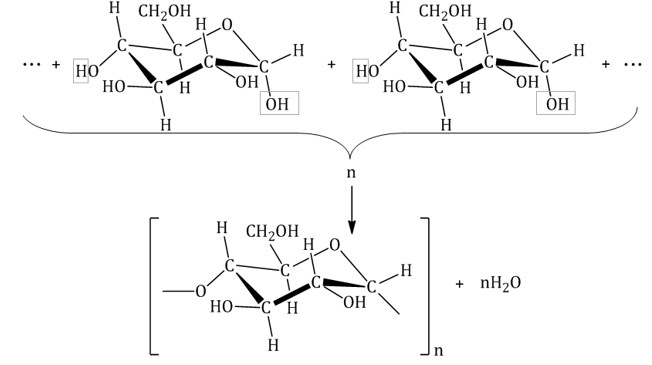
В его состав входят:
- амилоза (внутренняя часть крахмального зерна) – 10-20%
- амилопектин (оболочка крахмального зерна) – 80-90%
Цепь амилозы включает 200 — 1000 остатков α-глюкозы (средняя молекулярная масса 160 000) и имеет неразветвленное строение.
Амилопектин имеет разветвленное строение и гораздо большую молекулярную массу, чем амилоза.
Свойства крахмала
Гидролиз крахмала: при кипячении в кислой среде крахмал последовательно гидролизуется:
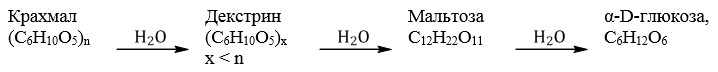
Запись полного гидролиза крахмала без промежуточных этапов:
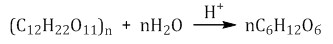
Крахмал не дает реакцию “серебряного зеркала” и не восстанавливает гидроксид меди (II).
Качественная реакция на крахмал: синее окрашивание с раствором йода.
Связанные материалы
 Реальный безтрансформаторный ламповый усилитель для низкоомных наушников по мотивам «Лаконика»…
Реальный безтрансформаторный ламповый усилитель для низкоомных наушников по мотивам «Лаконика»…
Безтрансформаторный ламповый усилитель для головных телефонов с максимальной возможностью…
 Ламповый усилитель на унифицированных трансформаторах ТН…
Ламповый усилитель на унифицированных трансформаторах ТН…
Не секрет, что серьезной проблемой при конструировании ламповых усилителей становится изготовление…
 Драйвер на ОУ для лампового усилителя. Строим гибридный однотактник…
Драйвер на ОУ для лампового усилителя. Строим гибридный однотактник…
Предлагаю вашему вниманию концепцию построения гибридного однотактника, на разработку которого меня…
 «SPRING» — триодный усилитель на лампах 6Н13С…
«SPRING» — триодный усилитель на лампах 6Н13С…
Чисто триодный усилитель с претензиями на истинный High–End. Почему именно триоды? Во-первых, триод…
 Двухтактный ламповый усилитель на ECC85 и EL34…
Двухтактный ламповый усилитель на ECC85 и EL34…
Раньше я с предубеждением относился к звучанию двухтактных ламповых усилителей, полагая, что…
 Двухтактный усилитель на ГУ-32…
Двухтактный усилитель на ГУ-32…
После подписки на USB-ЦАП на РСМ2702 «GOLDSMITH» встал ребром вопрос: «А на чем его слушать?»…
 Входной буфер и регулятор уровня громкости для УМЗЧ. Часть 3. Двухполярное питание…
Входной буфер и регулятор уровня громкости для УМЗЧ. Часть 3. Двухполярное питание…
Здравствуйте, уважаемые читатели! Этим небольшим, но полезным дополнением я продолжаю тему,…
 SMD практикум №3! Предварительный усилитель «Zero-FB» без ОС. Заказ плат и деталей (завершено)…
SMD практикум №3! Предварительный усилитель «Zero-FB» без ОС. Заказ плат и деталей (завершено)…
Предлагаемый вашему вниманию стереофонический предварительный усилитель «Zero-FB» состоит из…
 Симметричный УНЧ из доступных деталей по мотивам В. Короля…
Симметричный УНЧ из доступных деталей по мотивам В. Короля…
Хочу предложить начинающим любителям качественного звуковоспроизведения одну из разработанных и…
Двухтактный ламповый усилитель 10 Вт на двойных триодах (6Н1П + 6Н6П)…
Хочу поделиться своим опытом в создании лампового усилителя для домашнего использования. Этот…
6Н23П+КТ602Б. Лампово-транзисторный усилитель НЧ для стерео-телефонов…
Интересная схема С. Филина, попалась при листании старых журналов. Достигнуть малого уровня…
 Кремний против германия в усилителях одинаковой ретро-структуры и новый германиевый кит в конце…
Кремний против германия в усилителях одинаковой ретро-структуры и новый германиевый кит в конце…
Германий превыше всего? Да здравствует эксперимент! Предлагаемый стереофонический усилитель…
Свойства алкинов
Физические свойства
По физическим свойствам алкины мало отличаются от алкенов и алканов. Так, простейший алкин ацетилен — газ без вкуса и запаха, плохо растворимый в воде. Среди гомологов ацетилена есть и жидкие, и твёрдые вещества: чем больше молекулярная масса, тем выше температуры кипения и плавления алкинов.
Химические свойства
Для алкинов, как и для алкенов, характерны реакции присоединения. Они идут в две стадии:
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученный этилен содержит двойную связь, возможна вторая стадия этого процесса:
Вопрос. Возможна ли реакция присоединения для полученного вещества? Почему?
Таким образом, в результате реакции гидрирования из ацетилена можно получить и этилен, и этан. Всё зависит от условия процесса и от соотношения исходных веществ. Например, реакцию присоединения хлороводорода к ацетилену часто прерывают на первой стадии:
Дело в том, что хлорвинил применяется для получения полимера полихлорвинила.
Задание 20.3. Составьте уравнения реакции полимеризации хлорвинила.
Изделия из полихлорвинила (–СНСl–СН2–)n имеют разнообразное применение.
Так, полихлорвинил (ПХВ, или ПВХ) является основой для получения искусственной кожи, различной посуды одноразового пользования, полимерной тары, клеёнок, отделочных материалов и т. д. Многие пластмассовые изделия, которые мы используем каждый день, обивка салонов автомобилей, вагонов, самолётов, — сделаны из ПВХ. Он также используется для электроизоляции проводов.
Аналогично идут и другие реакции присоединения. Например, ацетилен, как и этилен, обесцвечивает бромную воду. Кроме того, он обесцвечивает и раствор перманганата калия, т. е. вступает в реакции окисления.
Задание 20.4. Составьте уравнения реакции ацетилена с бромом.
Таким образом, ацетилен тоже даёт качественные реакции на π-связь. Поэтому правильнее говорить, что реакции обесцвечивания бромной воды и перманганата калия — это качественные реакции на кратную связь. Другими словами, при помощи этих реакций можно обнаружить непредельные соединения, содержащие кратную связь, которая содержит π-связь.
Большое практическое значение имеет реакция присоединения воды к ацетилену — гидратация ацетилена. Поскольку эту реакцию открыл и изучил российский ученый М. Г. Кучеров*, она носит название «реакция Кучерова»:
Уксусный альдегид нужен для получения уксусной кислоты. Ацетилен горит.
Задание 20.5. Составьте уравнение реакции горения ацетилена.
Газообразные углеводороды можно различить по характеру пламени. Так, метан горит бесцветным пламенем, этилен — светящимся, а ацетилен — коптящим, т. е. углерод окисляется не полностью и частично выделяется в виде простого вещества (сажи). В токе кислорода ацетилен горит ослепительно-голубым пламенем с выделением большого количества теплоты (температура пламени превышает 3000 °C!). Поэтому эта реакция используется для газовой сварки и резки металлов.
При неполном окислении ацетилена (раствором перманганата калия) образуется смесь кислот.
Для ацетилена возможна реакция полимеризации, причём в эту реакцию может вступать небольшое число молекул. Так, при тримеризации ацетилена (соединяются три молекулы) образуется циклическое соединение — бензол:
Для алкинов характерна подвижность атомов водорода у тройной связи. За счёт этих атомов происходят реакции замещения таких атомов водорода:
Аналогичная реакция замещения происходит и с оксидом меди (I), и со щелочными металлами. В результате обеих реакций выделяется осадок, поэтому их считают качественными реакциями на алкины, в молекулах которых имеется атом водорода у тройной связи. Такая же реакция замещения происходит и со щелочными металлами.
Применение отдельных представителей
Крахмал и целлюлоза. Крахмал и целлюлоза относятся к полисахаридам. Они являются природными полимерами. Их молекулы состоят из сотен и тысяч групп атомов (C6H10O5)n, остатков молекулы глюкозы. Значения n в них разные. Молекулы целлюлозы намного длиннее, чем крахмала.
nцеллюлозы > nкрахмала
По своему строению их можно отнести к высокомолекулярным соединениям. Крахмал в основном образуется в процессе фотосинтеза.
n С6Н12О6 → (C6H10O5)n+ n Н2О
Этот процесс происходит в зеленых листьях растений. Накапливается крахмал в зернах, корнеплодах или плодах. Качественной реакцией на крахмал является взаимодействие с йодом. Появляется синее окрашивание (см. Рис. 2).
Рис. 2. Качественная реакция на крахмал с раствором йода. Синее окрашивание
Целлюлоза, или, как ее еще называют, клетчатка, с йодом не взаимодействует. Целлюлоза является основной частью оболочек клеток растений. В древесине содержится около 50% по массе целлюлозы. Именно из древесины получают метанол, уксусную кислоту, бумагу и многие другие ценные продукты.
Общим свойством углеводов является способность разлагаться при нагревании. При термическом разложении углеводов образуются сажа и вода.